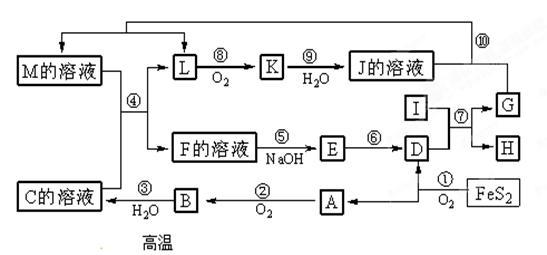
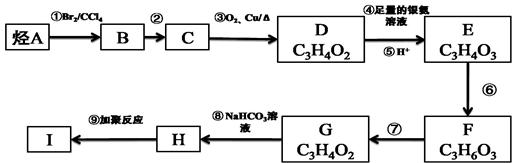
-
下列实验中所选用的仪器合理的是
A.用200 mL量筒量取5.2 mL稀硫酸
B.用250 mL容量瓶配制250 mL 0.2 mol/L的氢氧化钠溶液
C.用托盘天平称量11.75 g氯化钠晶体
D.用碱式滴定管量取25.1 mL溴水
难度: 简单查看答案及解析
-
在物质分类中,前者包括后者的是
A.氧化物、化合物 B.溶液、 分散系
C.溶液、 胶体 D.化合物、电解质
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L己烷中共价键数目为19NA
B.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
难度: 困难查看答案及解析
-
下面有关金属的叙述正确的是
A.金属原子只有还原性而其阳离子只有氧化性
B.金属阳离子只存于化合物中且有相应的阴离子相配合
C.金属单质在常温下均为金属晶体
D.某单质具有延展性则它一定是金属
难度: 中等查看答案及解析
-
下列实验操作中正确的是
A.蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处
B.制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下
C.分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出
D.测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A.v(O2)=0.001 mol·L-1·s-1 B.v(NH3)=0.01 mol·L-1·s-1
C.v(NO)=0.001 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.乙酸的结构简式: C2H4O2 B.F- 的结构示意图:
C.中子数为20 的氯原子:2017Cl D.NH3的电子式:
难度: 中等查看答案及解析
-
向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是
A.BaSO4 B.FeS C.BaSO3 D.S
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3—+H+=H2O+CO2↑
C.过量Na投入AlCl3溶液:Al3+ + 4Na + 2H2O = AlO2- + 4Na+ + 2H2↑
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:
2Ba2++Al3++2SO42-+4OH-===AlO2-+2BaSO4↓+ 2H2O
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
①常温下,c(H+)/c(OH—)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
②加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
③使酚酞变红的溶液:Fe3+、Al3+、NO3-、SO42-
④使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
⑤无色溶液中:K+、Al3+、NO3-、HCO3-
A.②③ B.①③ C.① D.①④⑤
难度: 困难查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O===2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱
D.若M+和R2-的核外电子层结构相同,则可推出原子序数:R>M
难度: 困难查看答案及解析
-
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
难度: 困难查看答案及解析
-
100g碳粉燃烧所得气体中,CO占2/3、CO2占1/3体积,且C(s)+1/2O2(g)=CO(g)△H=—110.35kJ/mol,CO(g)+1/2O2(g) =CO2(g) △H=—282.57kJ/mol, 与这些碳完全燃烧相比损失的热量是
A.784.92kJ B.2489.44 kJ C.1569.83kJ D.3274.3 kJ
难度: 中等查看答案及解析
-
能证明反应:H2(g)+ I2(g)
2HI(g)已经达到平衡状态的是
①c(H2):c(I2):c(HI)=1:1:2
②单位时间内生成nmolH2的同时消耗nmolI2
③反应速率2v(H2)=2v(I2)= v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
A.①③ B.②⑥ C.③⑥ D.④⑤
难度: 困难查看答案及解析