-
下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3+HCO3-
B.NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-
NH3+H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2
D.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO+H2O
难度: 中等查看答案及解析
-
对下列物质的化学用语书写正确的是
A.乙烯的结构简式为CH2CH2
B.羟基的电子式:
C.Ca2+的结构示意图为
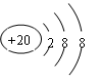
D.乙醇的分子式:CH3CH2OH
难度: 中等查看答案及解析
-
下列各组物质中,满足组内甲、乙、丙任意两种物质在一定条件下均能发生反应的是
物质组别
甲
乙
丙
A
NH3
O2
HNO3
B
Al
HCl
NaOH
C
SiO2
NaOH
HCl
D
CO2
Ca(OH)2
NaHSO3
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2-
B.使酚酞变红的溶液中可能大量存在Na+、ClO‾、SO42-、I‾
C.碱性溶液中可能大量存在Na+、K+、HCO3‾、CO32-
D.中性溶液中可能大量存在Fe3+、K+、SCN-、SO42-
难度: 中等查看答案及解析
-
以下关于胶体的说法不正确的是
A.胶体粒子能透过滤纸,但不能透过半透膜
B.Fe(OH)3胶体粒子具有较大的表面积,具有吸附性,能吸附阳离子,故在电场作用下会产生电泳现象
C.向Fe(OH)3胶体中逐滴滴入稀硫酸,会先出现红褐色沉淀然后沉淀消失的现象
D.只有胶体粒子能作布朗运动
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g);△H=-283.0kJ/mol
C.一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关。
D.需要加热才能发生的反应一定是吸热反应
难度: 中等查看答案及解析
-
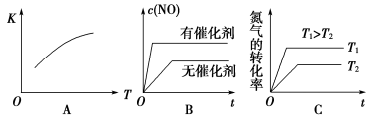
在密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法正确的是
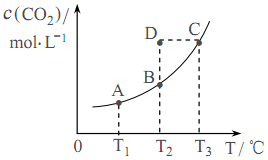
A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有V正<V逆
C.反应CO(g)+H2O(g)
CO2(g)+H2(g)的ΔH<0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol/LNaCl溶液含有NA个Na+
B.任意条件下,16gO3所含的原子数为NA
C.1molFe与足量稀HNO3反应,转移3NA个电子
D.标准状况下,22.4LSO3所含的分子数为NA
难度: 中等查看答案及解析
-
对于常温下0.1mol/L氨水和0.1mol/L醋酸,下列说法正确的是
A.0.1mol/L氨水,溶液的pH=13
B.0.1mol/L氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1mol/L醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1mol/L醋酸与0.1mol/LNaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
往碘化亚铁溶液中缓慢通入1.5mol氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量为
A.1.1mol B.1.5mol C.1.2mol D.1.0mol
难度: 中等查看答案及解析
-
下列对第ⅣA族元素及其化合物的性质的推断一定不正确的是
A.与同族硅元素类似,锗、锡、铅都可用做半导体材料
B.锗与盐酸可能不反应,锡、铅能与盐酸反应
C.锗、锡、铅的+4价氢氧化物的碱性由弱到强的顺序为:Ge(OH)4<Sn(OH)4<Pb(OH)4
D.锗、锡、铅的金属性依次减弱
难度: 中等查看答案及解析
-
3.0gFe2O3和A12O3组成的混合物全部溶于200mLpH=0的硫酸,反应后向所得溶液中加入100mLNaOH溶液,恰好使Fe3+、A13+完全沉淀,则加入的NaOH的浓度c(NaOH)为
A.1mol/L
B.2mol/L
C.4mol/L
D.8mol/L
难度: 困难查看答案及解析
-
已知:2R—Cl+2Na→R—R+2NaCl(R代表烃基),下列有机物通过上述反应可制得对二甲基环己烷的是
A.2,3—二氯丁烷
B.1,3—二氯丁烷
C.2—氯丁烷
D.2,5—二氯己烷和1,2—二氯乙烷
难度: 中等查看答案及解析

 。
。