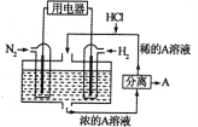
-
下列说法中,正确的是
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
C.明矾用于净水既与盐类的水解有关,又与胶体的眭质有关
D.棉花、羊毛及台成纤维完全燃烧都只生成二氧化碳和水
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.l mol的
分子中的中子数是2
B.标准状况下,一定量的铜与硝酸反应后生成22.4 LNO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于
C.100mL 1 mol /LNa[Al(OH)4]溶液中含有0.1
个[Al(OH)4]-
D.1 mol羟基和1mol氢氧根离子中的电子数和质子数均相等
难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液在阴极上依次析出Cu、Fe、Al
难度: 中等查看答案及解析
-
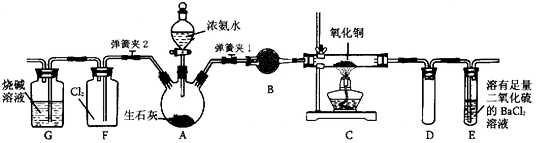
利用下列装置分别完成相关实验,能达到实验目的的是

难度: 困难查看答案及解析
-
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如下图所示,下列有关绿原酸的说法正确的是
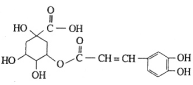
A.绿原酸的分子式为C16H12O9
B.绿原酸能和NaHCO3溶液发生反应放出CO2气体
C.1mol绿原酸最多与8 molNaOH反应
D.绿原酸分子中有4种化学环境不同的氢原子
难度: 中等查看答案及解析
-
原子结构决定元素的性质,下列说法中,正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第VIA族元素的氢化物(H2R)中,热稳定性最强的其沸点也最高
C.第2周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
难度: 中等查看答案及解析
-
有关下列图像的说法正确的是
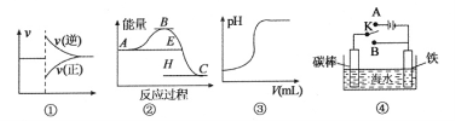
A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化
B.根据图②判断,物质A反应生成物质C的△H>O
C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化
D.图④中开关K置丁A或B处均可减缓铁的腐蚀
难度: 中等查看答案及解析
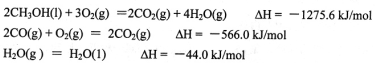
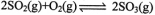 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。