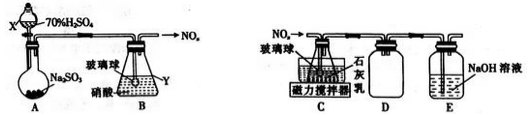
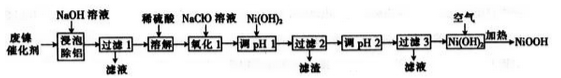
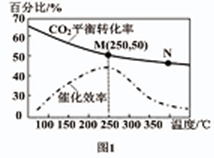
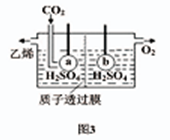
-
下列说法正确的是
A. 向海水中加入净水剂明矾可使海水淡化
B. 合成纤维、光导纤维都属于有机高分子材料
C. 利用加热的方法杀死人体内感染的埃博拉病毒
D. “雾”是微小水滴或冰晶组成的气溶胶系统,“霾”中的灰尘对大气中的有害物质起吸附作用
难度: 中等查看答案及解析
-
下列关于有机物的说法不正确的是
A. 有机物
 的一氯代物有5种
的一氯代物有5种B. 淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2悬浊液发生反应
C. 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
D. 乙醇被酸性KMnO4溶液充分氧化的化学方程式为:5CH3CH2OH +4KMnO4+6H2SO4 → 5CH3COOH+2K2SO4+ 4MnSO4 + 11H2O
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. 用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
C. 双氧水作脱氧剂,用于消除水中的氯气:Cl2+H2O2= 2H++O2+2Cl-
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++ Al3++SO42-+4OH-═AlO2-+2BaSO4↓+2H2O
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向KI溶液中加入CCl4,振荡后静置
液体分层,下层呈紫红色
碘易溶于CCl4,难溶于水
B
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
C
向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体
溶液红色变浅
证明Na2CO3溶液中存在水解平衡
D
向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液
产生白色沉淀
试样已氧化变质
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
X、Y、Z、M为构成生命体的基本元素,其原子序数依次增大,下列说法不正确的是
A. 四种元素可形成两种以上的盐
B. 四种元素中原子半径最大的为M
C. Y、Z、M的氢化物中,M的氢化物最稳定
D. 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应
难度: 中等查看答案及解析
-
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能。镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如下图所示,下列说法不正确是
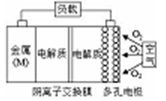
A. 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH-
B. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. 与铝一空气电池相比,镁一空气电池的比能量更高
D. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极
难度: 中等查看答案及解析
-
常温下,用0.1000mol·L-1的盐酸滴 0.1000mol·L-1Na2CO3溶液25.00mL。用pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
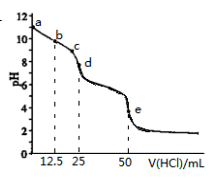
A. c→d点发生的主要离子反应:HCO3-+H+=H2O+CO2
B. 在b点时,c(CO32-)>c(HCO3-)>c(OH-)
C. 在d点时, c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. 在e点时, c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
难度: 困难查看答案及解析