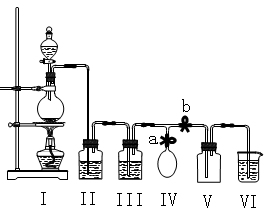
-
下列说法中正确的是
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.利用丁达尔效应可区分溶液与胶体
D.用加热的方法不能鉴别NaHCO3和Na2CO3
难度: 简单查看答案及解析
-
有NaCl、FeCl2 、FeCl3 、MgCl2 、CuCl2、AlCl3 、NH4Cl六种溶液, 只用一种试剂就可以把它们鉴别开来,该试剂是
A 稀H2SO4 B NaOH溶液 C 氨水 D 稀HNO3
难度: 中等查看答案及解析
-
根据下列反应所画图象正确的是
A
B
C
D
将二氧化硫通入到一定
量氯水中
将氯化铝溶液滴入到一定量NaOH溶液中
NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液中
将铁粉加入到一
定量氯化铁溶液中
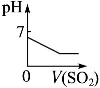
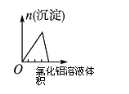
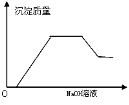
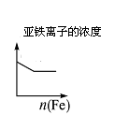
难度: 困难查看答案及解析
-
有甲、乙、丙、丁四种易溶于水的物质,分别由以下离子(NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-)中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论正确的是
A.甲为氯化钡 B.乙溶液含有Cl-
C.丙溶液含有 SO42- D.丁溶液含有NH4+
难度: 困难查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
紫色石蕊试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.
30 mL D.15 mL
难度: 困难查看答案及解析
-
下列物质属于纯净物的是
A.液氯 B.漂白粉 C.盐酸 D.碘酒
难度: 简单查看答案及解析
-
下列物质中,不能由相应的单质化合而成的是
A Na2O2 B
FeCl2 C Fe3O4 D Cu2S
难度: 简单查看答案及解析
-
一定量的浓硫酸跟过量的锌充分反应,产生的气体可能有
① SO2 ② SO3 ③ H2S ④ H2
A.①②③ B.①③④ C.①②④ D.只有①
难度: 简单查看答案及解析
-
某合作学习小组讨论辨析以下说法 ,其中说法正确的是
①纯碱和熟石灰都是碱;②沼气和水蒸气都是可再生能源;
③冰和干冰既是纯净物又是化合物;④硫酸和食醋既是化合物又是酸;
⑤不锈钢和目前流通的硬币都是合金;⑥粗盐和酸雨都是混合物。
A.③⑤⑥ B.②④⑥ C.①③⑤ D.①②③⑥
难度: 简单查看答案及解析
-
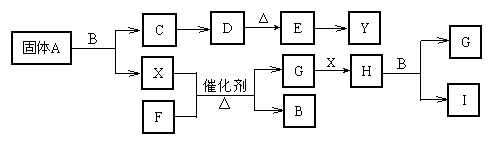
水热法制备纳米颗粒Y(化合物)的反应为:
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1 mol O2参加反应,转移的电子总数为4 mol
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.氧化铜溶于浓硝酸:CuO+2H+=Cu2++H2O
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
等量铝分别与足量的稀盐酸和氢氧化钠溶液反应,则放出的气体在相同状况下体积之比为
A.1∶1 B.2∶1 C.3∶1 D.1∶3
难度: 简单查看答案及解析
-
16O和18O是氧元素的两种核素,NA表示阿伏伽德罗常数,下列说法正确的是
A. 16O与18O互为同素异形体
B. 16O与18O核外电子排布方式不同
C. 通过化学变化可以实现16O2与18O3间的相互转化
D. 标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子
难度: 中等查看答案及解析
-
下列各组离子在酸性溶液中能大量共存的是
A、Na+、Fe2+、NO3-、SCN— B、Ca2+、K+、Cl—、NO3—
C、Al3+、K+、OH—、NO3— D、Na+、Ca2+、S
iO32—、Cl—
难度: 中等查看答案及解析
-
关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+。
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
难度: 中等查看答案及解析
-
标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=
B.ω=
C.ω=
D.C=
难度: 困难查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像中能正确表示加入盐酸的体积和生成CO2的物质的量的关系

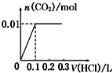
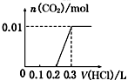

A B C D
难度: 困难查看答案及解析
-
元素X的单质及X和Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
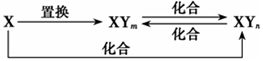
A. X为Fe,Y可为Cl、Br
B. X为Fe,Y只能为Cl
C. X一定为金属元素
D. X为Fe,Y可为Cl、Br、I
难度: 中等查看答案及解析
-
下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.向Fe2(SO4)3 溶液中加入一定量的铜粉,铜粉全部反应后,溶液中一定含有Fe2+
C.物质NaHCO3、Al2O3、Fe2O3、Al(OH)3、Al 都既能跟盐酸反应, 又能跟氢氧化钠溶液反应
D.铁在氧气中燃烧,生成黑色的Fe3O4
难度: 简单查看答案及解析