-
下列实验室制取NH3并进行干燥、收集验满和尾气处理的装置和原理能达到实验目的的是

A. 制取NH3 B. 干燥NH3 C. 收集NH3并验满 D. 吸收多余NH3
难度: 中等查看答案及解析
-
下列各组晶体中,化学键的类型相同是
A. SO2与MgO B. NaCl与HCl
C. CO2与H2O D. CCl4与KCl
难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层为8电子结构的是( )。
A. H2O B. BF3 C. PCl3 D. NO2
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.3NA
C. 标准状况下,1.12L 的SO2所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A. 盐酸与Na2SiO3溶液混合: SiO32-+2H+=H2SiO3↓
B. 浓盐酸和二氧化锰共热制取Cl2: MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
C. NO2通入水中: H2O+3NO2=2H++2NO3-+NO
D. 向澄清石灰水中通人过量SO2: SO2+Ca2++2OH-=CaSO4↓+H2O
难度: 中等查看答案及解析
-
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的叙述中错误的是
A.
的化学性质与
相同 B.
的原子序数为53
C.
的原子核外电子数为78 D.
的原子核内中子数多于质子数
难度: 中等查看答案及解析
-
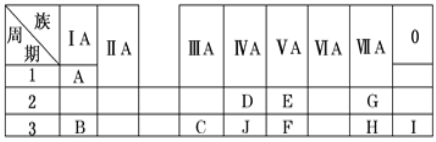
下表为六种短周期元素的部分性质。
元素代号
X
Y
Z
Q
R
T
原子半径/10-10m
0.37
0.74
0.75
0.82
0.99
1.10
主要化合价
+1
-2
+5、-3
+3
+7、-1
+5、-3
下列有关说法正确的是
A. 元素X、Y、Z形成的化合物一定是离子化合物
B. 元素R的氧化物对应水化物一定为强酸
C. 元素Y的同族氢化物中,稳定性最强的其沸点就最低
D. 元素Z的简单气态氢化物的热稳定性比元素T的稳定
难度: 中等查看答案及解析
-
下列用电子式表示物质的形成过程正确的是( )
A.
B.
―→Na
C.
―→
D.
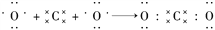
难度: 中等查看答案及解析
-
a、b 、c 、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A. d与a形成的化合物的溶液呈弱酸性
B. a与其他三种元素形成的化合物中其化合价均为+1
C. c的原子半径是这些元素中最大的
D. b与其他三种元素均可形成至少两种化合物
难度: 中等查看答案及解析
-
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )
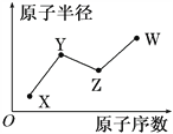
A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素
D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
难度: 中等查看答案及解析
-
与NO3-互为等电子体的是
A. SO3 B. P4 C. PCl3 D. NO2
难度: 困难查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是
A. 基态原子的N层上只有一个电子的元素,一定是ⅠA 族元素
B. 原子的价电子排布为(n-1)d6-8ns2的元素一定是副族元素
C. 最外层有三个未成对电子的原子一定属于主族元素
D. 基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
难度: 中等查看答案及解析