-
下列说法正确的是
A.若反应X+Y===M是放热反应,该反应一定不用加热
B.需要加热方能发生的反应一定是吸热反应
C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
D.1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的能量称为中和热
难度: 中等查看答案及解析
-
化学与生产、生活和社会密切相关.下列说法不正确的是
A. 工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念
B. 外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
C. 14C可用于文物的年代鉴定,14C和12C互为同位素
D. 工业生产中,常在元素周期表金属与非金属分界线附近寻找催化剂
难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 氯化氢的电子式:
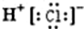
B. Ca2+的结构示意图:

C. 次氯酸的结构式:H—Cl—O
D. 质子数为53,中子数为78的碘原子:
I
难度: 中等查看答案及解析
-
一般情况下,前者能决定后者的是
A. 化学反应速率的快慢——化学反应进行的程度
B. 反应物内部储存的能量——化学反应的热效应
C. 原子核外电子排布——元素在周期表中的位置
D. 元素非金属性的相对强弱——含氧酸的酸性强弱
难度: 中等查看答案及解析
-
2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是
A. 2mol/L盐酸与锌反应时,加入4mol/L的氯化钠溶液,生成氢气的速率加快
B. 对于可逆反应2CO+2NO
N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
C. 工业上合成氨是放热反应,升高温度,正反应速率减慢
D. 在K2SO4和BaCl2两溶液反应时,增大压强,生成沉淀速率加快
难度: 中等查看答案及解析
-
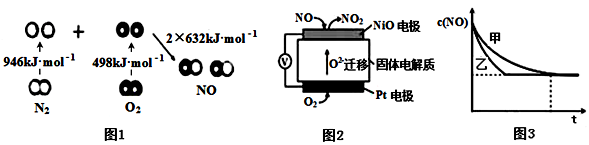
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )

A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
难度: 简单查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
同主族元素的最外层电子数相同
同主族元素均有相似的化学性质
B
原电池可将化学能转化为电能
原电池需外接电源才能工作
C
S的非金属性比Si强
酸性:H2SO4>H4SiO4
D
Na在Cl2中燃烧的生成物含离子键
NaCl固体可导电
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D.
Cl 与
Cl 得电子能力相同
难度: 中等查看答案及解析
-
下列结论正确的是
A. 某元素的一种核素的核内质子数为m,中子数为n,由此一定能确定该元素的近似相对原子质量为m+n
B. 短周期元素X、Y、Z,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子的还原性大于等电荷数Y的阴离子的还原性,那么原子序数大小是Z>X>Y
C. 第118元素在元素周期表中的位置是第七周期VIA族
D. 碱金属单质的熔沸点和卤素单质的熔沸点都是随核电荷数的递增而升高
难度: 简单查看答案及解析
-
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )

A.该反应的化学方程式为3B+4D=6A+2C
B.反应进行到6s时υ(B)=υ(C)
C.反应进行到6s时,用B表示的平均反应速率为0.05mol·L-1·s-1
D.反应进行到6s时,反应停止了
难度: 中等查看答案及解析
-
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应。下列说法正确的是
A. 达到化学平衡时,正反应速率与逆反应速率不相等
B. 反应过程中,Y的单质的体积分数始终为50%
C. 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D. 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
难度: 困难查看答案及解析
-
某实验兴趣小组按如图装置实验后,所记录内容合理的是
实验
记录
①Zn质量减少,Cu质量不变;

②外电路电流方向是:由Cu→Zn;
③SO42﹣ 向Cu极移动;
④Zn电极发生氧化反应;
⑤正极反应式:Cu2++2e﹣═Cu
A. ①②④ B. ②③④ C. ②④⑤ D. ①③⑤
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
元素代号
X
Y
Z
W
Q
原子半径/pm
160
143
70
66
102
主要化合价
+2
+3
+5、﹣3
﹣2
+6、﹣2
A. X、Y元素的金属性 X<Y
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. W、Q两元素的气态氢化物的热稳定性 H2W>H2Q
难度: 困难查看答案及解析