-
下列分子的稳定性的比较正确的是( )
A. HF>HI B. CH4<SiH4 C. PH3>NH3 D. H2O<H2S
难度: 中等查看答案及解析
-
能够用键能的大小作为主要依据来解释的是( )
A. 常温常压下氯气呈气态,而溴单质呈液态 B. 硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C. 稀有气体一般难发生化学反应 D. 空气中氮气的化学性质比氧气稳定
难度: 中等查看答案及解析
-
把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
A.CCl4 B.C2H5OH C.CS2 D.C6H6
难度: 中等查看答案及解析
-
根据价层电子对互斥理论及原子的杂化轨道理论判断NF3分子的空间构型和中心原子的杂化方式为( )
A. 直线形 sp杂化 B. 三角形 sp2杂化
C. 三角锥型 sp2杂化 D. 三角锥型 sp3杂化
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A. sp,范德华力 B. sp2,范德华力 C. sp2,氢键 D. sp3,氢键
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 在气体单质分子中,一定含有σ键,可能含有π键
B. 烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C. 等电子体结构相似,化学性质相同
D. 共价键的方向性决定了原子在形成分子时相互结合的数量关系
难度: 中等查看答案及解析
-
下列既有离子键又有共价键的化合物是( )
A. Na2O B. NaOH C. CaBr2 D. HF
难度: 中等查看答案及解析
-
B3N3H6与C6H6是等电子体,则下列说法不正确的是( )
A. B3N3H6能发生加成反应和取代反应 B. B3N3H6具有碱性
C. B3N3H6各原子在同一平面上 D. B3N3H6不能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 含有非极性键的分子一定是非极性分子 B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子 D. 键的极性与分子的极性有关
难度: 中等查看答案及解析
-
1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相似。根据上述原理,下列各对粒子中,空间结构相似的是
A.SO2与O3 B.CO2与NO2 C.CS2与NO2 D.PCl3与BF3
难度: 中等查看答案及解析
-
对SO3的说法正确的是( )
A. 结构与NH3相似 B. 结构与SO2相似
C. 结构与BF3相似 D. 结构与P4相似
难度: 简单查看答案及解析
-
下列关于杂化轨道的叙述中,不正确的是
A. 分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
C. 杂化前后的轨道数不变,但轨道的形状发生了改变
D. sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
难度: 中等查看答案及解析
-
下列分子中所有原子的价电子层都满足最外层8电子结构的是( )
A. 六氟化氙(XeF6) B. 次氯酸(HClO) C. 二氯化硫(S2Cl2) D. 三氟化硼(BF3)
难度: 中等查看答案及解析
-
下列共价键的键能最大的是( )
A. H—F B. H—O C. H—N D. H—C
难度: 中等查看答案及解析
-
关于乙醇分子的说法正确的是( )
A. 分子中共含有8个极性共价键 B. 分子中不含非极性键
C. 分子中只含σ键 D. 分子中含有1个π键
难度: 简单查看答案及解析
-
某配合物的分子结构如图所示,其分子内不含有( )
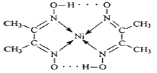
A.离子键 B.共价键 C.配位键 D.氢键
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 三角锥形;平面三角形 D. 直线形;平面三角形
难度: 中等查看答案及解析
-
下列各种说法中错误的是( )
A. 形成配位键的条件是一方有空轨道另一方有孤电子对
B. 配位键是一种特殊的共价键
C. NH4NO3、H2SO4都含有配位键
D. 共价键的形成条件是成键原子必须有未成对电子
难度: 中等查看答案及解析

