-
化学与生活、社会密切相关,下列说法不正确的是( )
A.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
C.Al2O3用作耐火材料、Al(OH)3用作阻燃剂
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 简单查看答案及解析
-
下列有关说法中,正确的是( )
①钢较纯铁不易生锈;
②冶炼铝和钠都可以用电解法;
③KSCN溶液可以检验Fe3+离子;
④缺钙会引起骨质疏松,缺铁会引起贫血;
⑤青铜、不锈钢、硬铝都是合金
A.①②③④⑤
B.②③④⑤
C.①③④
D.①②④⑤
难度: 中等查看答案及解析
-
下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO
)=0.1 mol·L-1的溶液中:NH
、AlO
、Cl-、NO
B.在由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO
C.在加入铝粉产生H2的溶液中:SO
、NO
、Na+、NH
D.在使红色石蕊试纸变蓝的溶液中:SO
、CO
、Na+、K+
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
难度: 中等查看答案及解析
-
下列事实对应的离子方程式正确的是( )
A.金属钠加入滴有酚酞的水中,溶液变红:Na+2H2O===Na++2OH-+H2↑
B.用NaOH溶液吸收多余的氯气:Cl2+2OH-===Cl-+ClO-+H2O
C.将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:
2HCO
+Ca2++2OH-===CaCO3↓+2H2O+CO
D.将醋酸溶液滴到大理石上有气泡产生:2H++CaCO3===CO2↑+Ca2++H2O
难度: 中等查看答案及解析
-
下列推测的说法中正确的是( )
A.已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
B.已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
C.已知Br2与Fe反应生成FeBr3,推测I2与Fe生成FeI3
D.已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
难度: 中等查看答案及解析
-
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
安全气囊碰撞时发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑,下列判断正确的是( )
A.每生成16 mol N2转移30 mol电子
B.NaN3中N元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1∶15
难度: 简单查看答案及解析
-
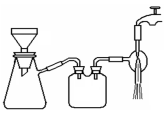
下列对于实验Ⅰ~Ⅳ的说法正确的是( )
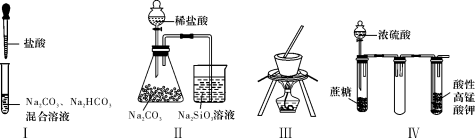
A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:可比较氯、碳、硅三种元素的非金属性强弱
C.实验Ⅲ:用饱和食盐水制取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 简单查看答案及解析
-
酚酞的结构如下图所示,有关酚酞说法不正确的是( )
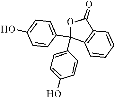
A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1 mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值分别为10 mol 和4 mol
难度: 中等查看答案及解析
-
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
稀盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
下列进行性质比较的实验,不合理的是( )
A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中
B.比较镁、铝的金属性:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中
C.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
D.比较氯、溴的非金属性:溴化钠溶液中通入氯气
难度: 简单查看答案及解析
-
下列物质的制备与工业生产相符的是( )
①NH3
NO
NO2
HNO3
②浓HCl
Cl2
漂白粉
③MgCl2(aq)
无水MgCl2
Mg
④饱和NaCl(aq)
NaHCO3
Na2CO3
⑤铝土矿
NaAlO2溶液
Al(OH)3
Al2O3
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
难度: 中等查看答案及解析
-
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
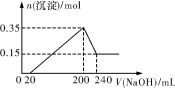
D.生成的H2在标准状况下的体积为11.2 L
难度: 中等查看答案及解析