-
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准正确的是( )
①钠的化合物; ②能与硝酸反应的物质; ③可“溶”于水的物质;
④电解质; ⑤钠盐; ⑥钠的含氧化合物.
A. ①③④⑤ B. ①②⑤⑥ C. ②⑤⑥ D. ①③④
难度: 简单查看答案及解析
-
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A. ①③ B. ②③ C. ③④ D. ④
难度: 简单查看答案及解析
-
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A. 分散质颗粒直径都在1~100 nm之间
B. 加热蒸干、灼烧后都有氧化铁生成
C. 呈红褐色
D. 能透过半透膜
难度: 中等查看答案及解析
-
下列溶液配制实验的描述完全正确的是
A. 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol •L-1)通常需要用容量瓶等仪器
C. 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解
D. 用pH =1的盐酸配制100 ml pH=2的盐酸所需全部玻璃仪器有100 ml容量瓶、烧杯、玻璃棒、胶头滴管
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 分子数为NA的CO和C2H4混合气体的体积约为22.4 L
B. 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
C. 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA
D. 0.1 L 3.0 mol·L-1的NH4NO3溶液中含有NH
的数目为0.3NA
难度: 简单查看答案及解析
-
三聚氰胺事件,使中国乳业多年走在阴影之中,现已步入复苏。三聚氰胺又名蛋白精[分子式为C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺说法正确的是( )
A. 2.52 g三聚氰胺含氮原子数目为0.12NA
B. 标准状况下,1 mol三聚氰胺的体积为22.4 L
C. 三聚氰胺含氮量约为10%
D. 三聚氰胺的摩尔质量为126 g
难度: 中等查看答案及解析
-
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ③转移溶液前容量瓶内有少量蒸馏水 ④定容时,俯视容量瓶的刻度线 ⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②③④
难度: 中等查看答案及解析
-
欲配制250 mL 0.5 mol·L-1的NaOH溶液,在下列仪器中,需要用到的仪器按先后顺序排列正确的是( )
①量筒 ②250 mL容量瓶 ③托盘天平和砝码 ④500 mL容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦漏斗 ⑧药匙 ⑨胶头滴管 ⑩250 mL烧瓶
A. ⑧⑤③⑥②⑨ B. ②③⑦⑤⑥
C. ②⑤⑦⑥① D. ④③⑦⑤⑥
难度: 中等查看答案及解析
-
V mL Al2(SO4)3溶液中含Al3+a g,取
mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.
mol·L-1 B.
mol·L-1 C.
mol·L-1 D.
mol·L-1
难度: 困难查看答案及解析
-
在海水浓缩过程中,析出盐的种类和质量见下表(单位g·L-1)。
海水密度
(g·mL-1)
CaSO4
NaCl
MgCl2
MgSO4
NaBr
1.20
0.91
1.21
0.05
3.26
0.004
0.008
1.22
0.015
9.65
0.01
0.04
1.26
0.01
2.64
0.02
0.02
0.04
1.31
1.40
0.54
0.03
0.06
当海水密度达到1.21~1.22 g·mL-1时,析出的盐中,质量分数最大的是( )
A. CaSO4 B. MgSO4
C. NaCl D. MgCl2
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L NO与11.2 L O2混合后气体的体积约为22.4 L
B. 1 L 0.2 mol·L-1 Al2(SO4)3溶液中的离子总数为NA
C. 标准状况下,22.4 L H2O所含原子个数大于3NA
D. 含4 mol HCl的浓盐酸跟足量MnO2加热反应,可制得Cl2的分子数为NA
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 若1 mol·L-1 HF溶液中H+数目为NA,则等体积的2 mol·L-1 HF溶液中H+数目为2NA
B. 44 g CO2、N2O组成的混合气体中所含有的原子数为3NA
C. 36 g 3H2中含有的中子数目为24NA
D. 2.24 L O2与钠反应时,转移电子数目可能为0.3NA
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2NA
B. 标准状况下,4.48 L氨气分子中含0.6NA个N—H键
C. 100 mL 0.2 mol·L-1的FeCl3溶液中,含Fe3+数为0.02NA
D. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B. 常温常压下,18 mL水中所含氢离子数约为10-7NA
C. 标准状况下,22.4 L氦气中含有的原子数约为NA
D. 23 g组成为C2H6O的有机物,C—H键数目为3NA
难度: 简单查看答案及解析
-
如图表示1 g O2与1 g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
A. C2H4 B. CH4 C. CO2 D. NO
难度: 中等查看答案及解析
-
为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
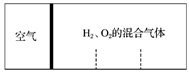 分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。
分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为_________________。