-
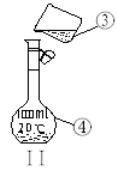
As2O3俗称砒霜,在盛放As2O3的试剂瓶标签上应印有下列警示标记中的( )

难度: 简单查看答案及解析
-
对于某些常见离子的检验及结论一定正确的是( )
A.加稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42-
C.加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
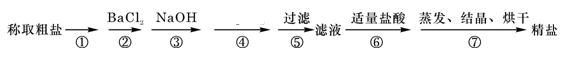
在“粗盐提纯”的实验中,蒸发时正确的操作是( )
A. 把浑浊的液体倒入蒸发皿内加热
B. 开始析出晶体后再用玻璃棒搅拌
C. 待水分完全蒸干后停止加热
D. 蒸发皿中出现大量固体时即停止加热
难度: 简单查看答案及解析
-
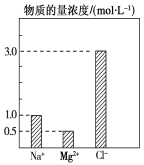
200ml 0.2mol/L 的NaOH溶液与300ml 0.1mol/L 的稀硫酸混合,混合后Na+的物质的量浓度是 ( )
A.0.2mol/L B.0.06 mol/L C.0.12 mol/L D.0.08mol/L
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.常温下,48gO3和O2含有的氧原子数为3NA
B.1molOH-离子中含电子数目为10NA
C.0.5L 0.2mol·L-1的NaCl溶液中含有的Na+数是0.1NA
D. 33.6LCO中含有的原子数是3NA
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A.在一定温度和压强下,各种气态物质
体积大小由构成气体分子大小决定
B.在一
定温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
难度: 中等查看答案及解析
-
如果1g H2O中含有m个H原子,则阿伏加德罗常数为( )
A.18m B.9m C.2m D.m/9
难度: 中等查看答案及解析
-
某物质A在一定条件下完全分解,生成B和C两种气体:2A = 2B + C 。在相同条件下,上述反应生成的混合气体相对H2密度是d,则A的摩尔质量是( )
A.d B.2d C.3d D.4d
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是( )
A.500mL溶液中Cl-离子浓度为0.2mol·L-1
B.500mL溶液中Ba2+离子浓度为0.2mol·L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.3NA
难度: 简单查看答案及解析
-
某同学想用实验证明FeCl3溶液显黄色不是Cl-造成的,下列实验中无意义的是( )
A.观察KCl溶液没有颜色
B.加水稀释后FeCl3溶液黄色变浅
C.向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失
D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失
难度: 简单查看答案及解析
-
下列溶液中
,与100 ml
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A.1
00 ml 0.5 mol/L MgCl2 溶液
B.200 ml 0.25 mol/L CaCl2溶液
C.50
ml 1 mol/L NaCl溶液
D.200 ml 0.25 mol/L HCl溶液
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲
、乙两种气体,若两容器的温度和压强均相同,且[甲的密度大于乙的密度,则下列说法正确的是 ( )
A.甲的分子数比乙的分子数多
B.甲的摩
尔体积比乙的摩尔体积小
C.甲的相对分子质量比乙的相对分子质量小
D.甲的物质的量比乙的物质的量少
难度: 中等查看答案及解析
-
在一定条件下,2体积XY3气体分解生成1体积Y2和2体积气态化合物甲。则甲的化学式为( )
A. XY B.XY2 C.XY3
D.X2Y3
难度: 中等查看答案及解析
-
含相同分子数的H2O和NH3具有相同的( )
A.体积 B.原子数 C.电子数 D.质量
难度: 中等查看答案及解析
-
下列各组物质中,所含分子数相同的是( )
A.10g H2和10g O2
B.5.6LN2(标准状况)和11gCO2
C.9g H2O和1mol Br2
D.224ml H2(标准状况)和0.1mol N2
难度: 中等查看答案及解析
-
关于0.1 mol·L-1 Na2CO3溶液的叙述错误的是
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液
中含Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol·L-1
D .取该溶液10 mL,加水稀释至100 mL后,Na2CO
3的物质的量浓度为0.01 mol·L-1
难度: 中等查看答案及解析
-
VmLAl2(SO4)3 溶液中含Al3+ag,取V/4mL溶液稀释到4VmL,则稀释后溶液中SO42-的物质的量浓度是 ( )
A.125a/36V mol/L B.125a/18Vmol/L
C.125a/9V mol/L D.125a/54V mol/L
难度: 中等查看答案及解析
-
同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,说法正确的是:
①分子数比为11:16 ②密度比为11:16 ③体积比为16:11 ④原子个数为11:16
A.①③ B.①④ C.②③ D.②④
难度: 简单查看答案及解析
-
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1
,则下列关系中不正确的是
A.w=17c/(1 000ρ) B.ρ=(17V+22 400)/(22.4+22.4V)
C.w=17V/(17V+22 400) D.c=1 000 Vρ/(17V+22 400)
难度: 简单查看答案及解析
-
在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为24克,此混合气体中C和O两种原子的物质的量之比是
A.2∶7 B.3∶7 C.4∶7 D.5∶7
难度: 简单查看答案及解析