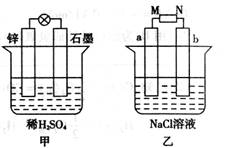
-
下列反应的热量变化方式与其它三个不相同的是
A.铝粉与氧化铁的反应 B.氯化铵与消石灰的反应
C.锌片与稀硫酸反应 D.钠与冷水反应
难度: 简单查看答案及解析
-
可以充分说明反应P(g)+ Q(g)
R(g)+ S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.明矾可作净水剂
C.加热氯化铁溶液颜色变深 D.硫酸氢钠溶液显酸性
难度: 简单查看答案及解析
-
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)== 2CO2(g)+4H2O(l); ΔH=+890kJ·mol-1
B.CH4(g)+2O2(g)== CO2(g)+2H2O(l); ΔH=+890kJ·mol-1
C.CH4(g)+2O2(g)== CO2(g)+2H2O(l); ΔH=-890kJ·mol-1
D.1/2CH4(g)+ O2(g)== 1/2CO2(g)+ H2O(g);ΔH=-445kJ·mol-1
难度: 简单查看答案及解析
-
2012年4月22日是第43个“世界地球日”,我国“十二五”期间地球日主题宣传活动的主题为“珍惜地球资源,转变发展方式”。下列行为不符合活动主题的是
A.更新采煤、采油技术,提高产量以满足工业生产快速发展的需要
B.控制含磷洗涤剂的使用,防止水体富营养化,保护水资源
C.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
D. 落实资源的“3R”发展观,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、
资源的循环再生(Recycle)
难度: 简单查看答案及解析
-
在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中一定能大量共存的离子组是
A.Fe2+、 Na+、 NO3-、 Cl- B.Ba2+、Na+、 NO3-、Cl-
C.SO42-、C6H5O-、NH4+、Na+ D.Mg2+、Na+、Br -、AlO2-
难度: 简单查看答案及解析
-
下列说法正确的是
A.物质的溶解性为难溶,则该物质不溶于水
B.物质的溶解度都随温度的升高而增大
C.绝对不溶于水的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 ( )
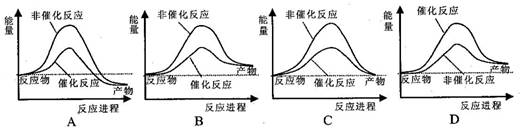
难度: 简单查看答案及解析
-
下列不能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.H2、I2、HI平衡混和气加压后颜色变深
D.打开啤酒瓶盖,瓶口冒出大量气泡
难度: 简单查看答案及解析
-
下列说法正确的是
A.物质发生化学反应时必然伴随着能量变化
B.金属铜导电,故金属铜是电解质
C.自发反应都是熵增大的反应
D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
难度: 简单查看答案及解析
-
如下图,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
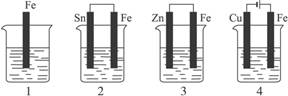
A.4>2>1>3
B.2>1>3>4
C.4>2>3>1
D.3>2>4>1
难度: 简单查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中: c(Cl—)>c(NH4+)
B.pH=2的一元酸和pH=12的一元碱等体积混合:c(OH—)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中: c(NH4+)> c(SO42—)> c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH—)=c(H+)>c(HS—)> c(H2S)
难度: 简单查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.该反应的熵变△S<0
C.Z的体积分数减小 D.X的转化率下降
难度: 简单查看答案及解析
-
下列水解离子方程式正确的是:
A.CH3COO— + H2O
CH3COOH + OH— B.NH4+ + H2O
NH4OH + H+
C.S2—+ 2H2O
H2S + 2 OH— D.Cu2+ + 2H2O=Cu(OH)2↓+ 2H+
难度: 简单查看答案及解析
-
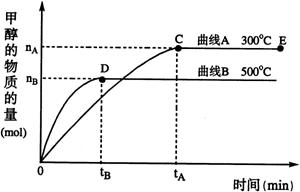
已知某可逆反应:mA(g)+nB(g)
pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t、温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
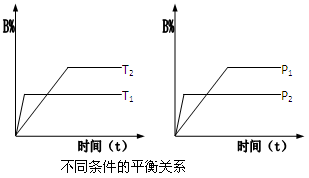
A.T1<T2,p1>p2,m+n>p,△H>0
B.T1>T2,p1<p2,m+n>p,△H>0
C.T1>T2,p1<p2,m+n<p,△H<0
D.T1>T2,p1>p2,m+n>p,△H<0
难度: 简单查看答案及解析
-
在测定中和热的实验中,下列说法正确的是
A.用0.5 mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 使用环形玻璃搅拌棒是为了使反应物混合均匀,加快反应速率,减小实验误差
D. 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
难度: 简单查看答案及解析
-
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
难度: 简单查看答案及解析
-
有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2
N2O4 △H<0,则以下说法正确的是:( )
A.反应起始时两容器的反应速率va和vb的关系:va<vb
B.反应过程中两容器内的反应速率va和vb的关系:va<vb
C.反应达到平衡时,两容器内压强相同
D.反应达到平衡时,两容器的NO2的转化率相同
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
A. 酸式滴定管用水润洗后,直接注入标准浓度的盐酸
B. 滴定过程中,滴定管有少量漏液
C. 滴定前读数准确,滴定完毕俯视读数
D. 锥形瓶用水润洗后,再用待测的氢氧化钠润洗
难度: 简单查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性 B.水的离了积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
难度: 简单查看答案及解析
-
下图是一甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是
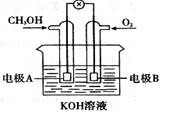
A.电极A为电池负极
B.电极B表面上发生还原反应
C.工作一段时间溶液pH保持不变
D.燃料电池工作时不会出现火焰
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 简单查看答案及解析
-
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01 mol·L-1NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
难度: 简单查看答案及解析