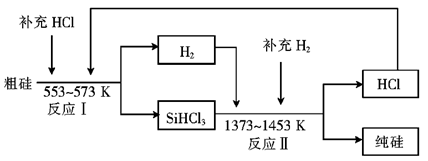
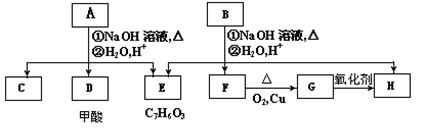
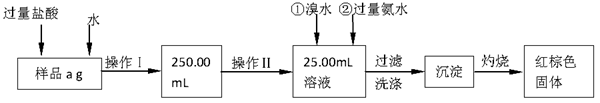
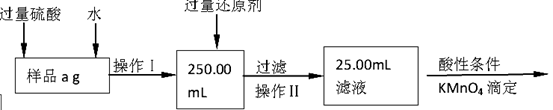
-
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
难度: 中等查看答案及解析
-
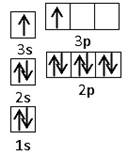
用NA表示阿伏加德罗常数,下列说法中正确的有
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol•L-1的CaCl2溶液中含Cl-的数目为2NA ;
难度: 中等查看答案及解析
-
有关如图所示化合物的说法不正确的是
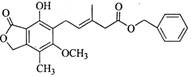
A.既可以与Br2的CCl4溶液发生加成反应,又可以 在光照下与Br2发生取代反应
B.1 mol该化合物最多可以与3 mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
难度: 困难查看答案及解析
-
下列操作或实验现象预测正确的是
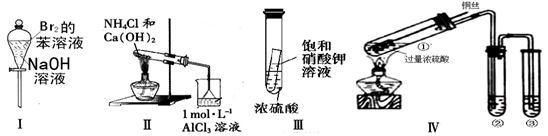
A. 实验I:振荡后静置,下层溶液颜色变深
B.实验Ⅱ :烧杯中先出现白色沉淀,后溶解
C. 实验III:放置一段时间后,小试管内有晶体析出
D.实验Ⅳ:为确认CuSO4生成,向①中加水,观察颜色
难度: 中等查看答案及解析
-
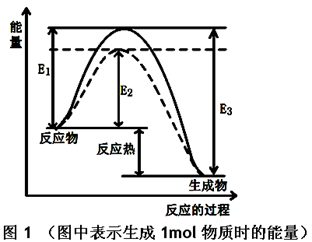
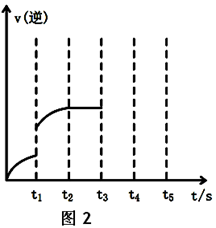
为了探索外界条件对反应:aX(g)+bY(g)
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
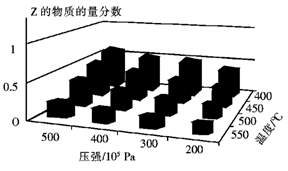
A.△H<0,a+b>c
B.△H>0,a+b<c
C.△H>0,a+b>c
D.△H<0,a+b<c
难度: 中等查看答案及解析
-
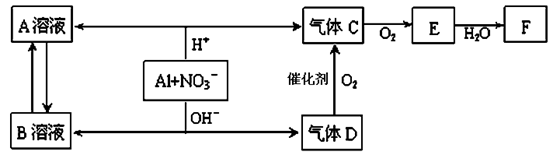
已知A、B为单质,C为化合物。
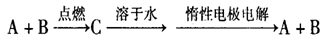
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
难度: 中等查看答案及解析
-
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
A.22.1 g B.27.2 g C.30 g D.无法计算
难度: 中等查看答案及解析