-
反应CH3OH(l)+ NH3(g)=CH3NH2(g)+ H2O(g)在某温度自发向右进行,若反应的│△H│= 17kJ/mol,│△H-T△S│=17kJ/mol,则下列正确的是( )
A. △H>0,△H- T△S<0 B. △H<0,△H- T△S >0
C. △H>0,△H- T△S >0 D. △H<0,△H- T△S <0
难度: 简单查看答案及解析
-
下列说法错误的是
A. 热化学方程式各物质前的化学计量数不能表示分子个数只代表物质的量。
B. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据。
C. 同一化学反应化学计量数不同,△H不同;化学计量数相同而状态不同,△H不相同
D. 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应又属于吸热反应的是
A. 铝热反应 B. 镁和盐酸的反应
C. 硫酸与氢氧化钾的反应 D. 灼热的碳与二氧化碳的反应
难度: 中等查看答案及解析
-
对于可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4V正(O2)=5v逆(NO)
B. 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系: 2V正(NH3)=3v逆(H2O)
难度: 中等查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 加催化剂,使N2和H2在一定条件下转化为NH3
C. 可用浓氨水和氢氧化钠固体快速制取氨气
D. 增大压强,有利于SO2和O2反应生成SO3
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应的平衡常数不变
难度: 中等查看答案及解析
-
可逆反应2A(g)+3B(g)
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
难度: 中等查看答案及解析
-
一定条件下,在某密闭容器中进行如下反应:
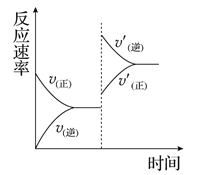
mA(g)+nB(g)
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
难度: 困难查看答案及解析
-
下列热化学方程式正确的是( )
A. C2H5OH+3O2=2CO2+3H2O △H=-1367.0kJ/mol
B. NaOH(aq)+ HCl( aq)=NaCl(aq)+ H2O(l) △H =+57.3 kJ/ mol
C. S(s)+ O2 (g)=SO2 (g) △H =-269.8 kJ/ mol
D. 2NO(g)+O2(g)=2NO2(g) △H =-116.2 kJ
难度: 中等查看答案及解析
-
下列有关能量的判断或表示方法正确的是( )
A. 从C(石墨)=C(金刚石) △H=+1.9 kJ /mol,可知金刚石比石墨更稳定
B. 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
C. 由H+(aq)+OH-(aq)=H2O(l) △H=-57 3kJ/ mol,可知含1mol CH3COOH 的溶液与含1molNaOH 的溶液混合,放出热量等于57.3 kJ
D. 2gH2完全燃烧生成液态水放出285.8 kJ 热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) △H=-285.8 kJ/mol
难度: 中等查看答案及解析
-
下列内容与结论相对应的是
选项
内容
结论
A
H2O(g)变成H2O(l)
△S>0
B
硝酸铵溶于水可自发进行
因为△S>0
C
一个反应的△H>0,△S>0
反应一定不自发进行
D
H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K)
反应在任意外界条件下均可自发进行
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
对于可逆反应3H2(g) + N2(g)=2NH3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A. 增大压强 B. 充入更多N2 C. 使用高效催化剂 D. 降低温度
难度: 简单查看答案及解析
-
将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
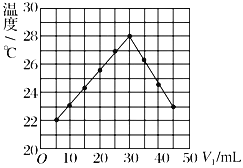
A. 做该实验时环境温度为22℃ B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0 mol/L D. 该实验表明有水生成的反应都是放热反应
难度: 简单查看答案及解析
-
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入2mL盐酸于试管中。下列对烧杯中的实验现象的描述及原因说明中正确的是( )

A. 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
B. 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C. 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系
D. 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
难度: 困难查看答案及解析
-
已知: (1)Zn(s)+1/2O2(g)=ZnO(s) ΔH=-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g)=Ag2O(s) ΔH=-31.0 kJ/mol
则Zn O(s)+2Ag(s)=Zn(s)+Ag2 O(s)的△H 等于()
A. -317.3kJ/mol B. -379.3kJ/mol C. +317.3kJ/mol D. -332.8kJ/mol
难度: 中等查看答案及解析
