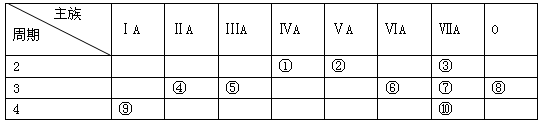
-
下列各组物质中互为同位素的是 ( )
A.
和
B. D和T
C. H2O和H2O2 D. O3和O2
难度: 简单查看答案及解析
-
阴离子
含中子N个,X的质量数为A,a g X的氢化物中含质子的物质的量是( )
A.
mol B.
mol
C.
mol D.
mol
难度: 简单查看答案及解析
-
下列各组性质比较中,正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
A.①②③ B.②③④ C.①②④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
如果发现了原子序数为116的元素,下列对它的叙述中正确的是 ( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性 ⑤属于氧族元素 ⑥属于锕系元素
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
难度: 简单查看答案及解析
-
下列关于碱金属元素和卤素的说法中,错误的是( )
A.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与H2的反应比碘单质与H2的反应更剧烈
难度: 中等查看答案及解析
-
关于元素周期表,下列叙述中不正确的是 ( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律的表述正确的是 ( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
A.原子半径:W> Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.4种元素的单质中,Z单质的熔、沸点最低
D.W单质能与水反应,生成一种具有漂白性的物质
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.①③⑥ B.②④⑥ C.②③④ D.①③⑤
难度: 中等查看答案及解析
-
下列各组物质中化学键的类型相同的是 ( )
A.CaCl2 MgCl2 Na2O B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4 D.NH4Cl H2O CO2
难度: 中等查看答案及解析
-
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是 ( )
A.N5+共有34个核外电子 B.N5+中氮原子间以共价键结合
C.化合物N5ASF6中AS的化合价为+1价 D.化合物N5ASF6中F的化合价为 -1价
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
A.反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
难度: 困难查看答案及解析
-
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为( )
A.放热91.5kJ B.放热183kJ C.吸热183kJ D.吸热91.5kJ
难度: 中等查看答案及解析
-
下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )

难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢
难度: 简单查看答案及解析
-
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2 + 2H2O + 4e- = 4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
难度: 中等查看答案及解析
-
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
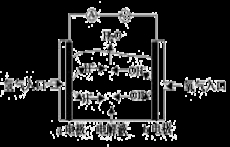
A.a电极是负极
B.b电极的电极反应为:4OH--4e-==2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置
难度: 中等查看答案及解析
-
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )

难度: 中等查看答案及解析
-
铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
难度: 中等查看答案及解析