-
下列说法错误的是
A.反应产物的总焓与反应物的总焓之差,称为反应焓变
B.反应产物的总焓小于反应物的总焓,该反应为吸热反应
C.同一反应在不同温度下进行,其焓变是不同的
D.已知2NO2(g)=N2O4(g) △H1,N2O4(g)=2NO2(g) △H2,则△H1=-△H2
难度: 中等查看答案及解析
-
某可逆反应当正反应速率增大时,下列说法正确的是
A.逆反应速率一定增大 B.平衡一定向正反应方向进行
C.反应物的转化率一定增大 D.该反应的条件一定发生变化
难度: 中等查看答案及解析
-
下列关于氯化铵溶液的说法正确的是
A.升高温度,氯化铵水解程度增大
B.水解平衡向右移动,溶液的pH一定减小
C.向溶液中加入氯化钠固体,能抑制氯化铵的电离
D.向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大
难度: 中等查看答案及解析
-
下列事实能说明某物质是强电解质的是
A.该物质在水中的溶解度大
B.该物质的水溶液导电能力强
C.该物质的水溶液中不存在溶质分子
D.该物质的水溶液中不存在除水外的电离平衡
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液的说法正确是
A.电解氯化钾溶液的过程中,溶液的pH变小
B.电解硝酸银溶液的过程中,阴极质量不变,阳极质量增大
C.电解硫酸钠溶液的过程中,两极产生气体的物质的量不相同
D.电解氢氧化钠溶液的过程中,氢氧化钠的物质的量浓度减小
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液中:K+、Fe2+、Cl-、NO3-
B.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
C.pH=12的溶液中:K+、NH4+、SO42-、NO3-
D.水电离产生的cOH-=1×10-14mol·L-1:K+、Na+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列关于平衡常数的说法正确的是
A.改变外界条件使化学平衡状态改变时,平衡常数也一定改变
B.改变条件,反应物的转化率增大,平衡常数一定增大
C.若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成
D.已知2NO2
N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=1/K2
难度: 中等查看答案及解析
-
下列应用不涉及到盐类水解的是
A.用热的纯碱清洗油污 B.氯气难溶于NaCl溶液中
C.明矾的净水作用 D.泡沫灭火器的使用原理
难度: 中等查看答案及解析
-
将浓度为0.1mol·L-1CH3COOH溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(CH3COO-)/c(H+) D.Ka(CH3COOH)
难度: 中等查看答案及解析
-
由铜、锌、CuSO4溶液,ZnSO4溶液组成如图所示的原电池,则下列说法正确是

A.a极为铜,b极为锌
B.A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液
C.当正极质量增加64g时,负极质量减小65g
D.盐桥中的阳离子向锌极移动,阴离子向铜极移动
难度: 困难查看答案及解析
-
NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)
N2(g)+2CO2(g) △H1。已知2NO(g)+O2(g)=2NO2(g) △H2;CO的燃烧热△H3;2NO2(g)+4CO(g)= N2(g)+4CO2(g) △H4;则下列关系式正确的是
A.△H4=△H1+△H3-△H2 B.△H4=△H1+2△H3-△H2
C.△H4=△H2+△H1+2△H3 D.△H4=2(△H2-△H1+2△H3)
难度: 困难查看答案及解析
-
已知分解1 mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
第一步:H2O2+I-→ H2O +IO- (慢);
第二步:H2O2+IO-→ H2O +O2+ I- (快)
下列有关反应的说法正确的是
A.I-和IO-都是该反应的催化剂
B.H2O2分解的速率取决于第二步反应的快慢
C.反应物的总能量比生成物总能量低98kJ
D.第一步H2O2被还原,第二步H2O2被氧化
难度: 困难查看答案及解析
-
在某容积一定的密闭容器中,有下列可逆反应xA(g) + B(g)
2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是
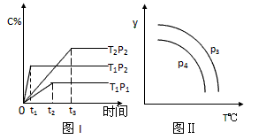
A.该反应是吸热反应
B.x=2
C.P3<P4,y轴可表示混合气体的相对分子质量
D.P3>P4,y轴可表示C物质在平衡体积中的百分含量
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH- + 2HCO3-=CaCO3↓+ CO32-+ 2H2O
B.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.NaHCO3溶液与稀H2SO4反应:CO32- + 2H+ = CO2↑+ 2H2O
D.铁与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
难度: 困难查看答案及解析
-
25℃时在10mL 0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
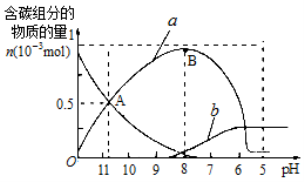
A.Na2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
B.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况
C.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3
难度: 困难查看答案及解析
-
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法正确的是

A.碳极发生的反应是:2H2O+O2+4e-=4OH-
B.有机电解质通过固体电解质可进入水溶液中
C.理论上,外电路中每转移1mol电子,负极消耗的质量为7g
D.该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极
难度: 中等查看答案及解析
-
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中c(OH-)/c(H+)=1×1012,下列叙述正确的是
A.HA的pH=3;BOH的pH=13
B.pH=a的HA溶液,稀释10倍,其pH=a+1
C.等体积的HA和BOH恰好完全反应,溶液的pH=7
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
难度: 中等查看答案及解析
-
活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),反应方程式为NO+C
E+F(未配平)。当温度为T时,经过5 min达到平衡,测得平衡时各物质的物质的量如下表:
活性炭
NO
E
F
初始时(mol)
2.050
0.200
0
0
平衡时(mol)
2.000
0.100
0.050
0.050
则下列说法正确的是
A.该反应的平衡常数为1/4
B.增加活性炭的量,能缩短达到平衡所用的时间
C.容器中压强不变可以说明该反应达到平衡状态
D.达到平衡时,用E表示该反应的速率为0.01 mol·L-1·min-1
难度: 中等查看答案及解析
-
(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g)
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_________________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
难度: 中等查看答案及解析



