-
下列有关物质性质的运用错误的是( )
①Na2O2与CO2反应放出的氧气:供矿山、坑道等地呼吸之用
②各种金属单质特殊的焰色:节日焰火
③三聚氰胺含有化合态的氮元素:补充人体蛋白质
④氢氟酸有强腐蚀性:雕刻玻璃
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
下列“反应”中不是化学反应的是 ( )
A.显色反应 B.焰色反应C.颜色反应 D.水解反应
难度: 简单查看答案及解析
-
下列各组反应能产生可燃性气体的是( )
A.铜投入到浓硝酸中B.碳投入到热的浓硫酸中
C.电石投入到水中D.碳酸钙投入到盐酸中
难度: 简单查看答案及解析
-
下列各组物质的分类正确的是( )
A.同位素:1H、2H、3H
B.非电解质:Cl2、NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2
D.同系物:
-OH、CH3-
-OH、CH3-
-CH2OH
难度: 简单查看答案及解析
-
下列实验数据记录正确的是( )
A.用天平称取4.0g NaOH固体,用100ml量筒配制1.0000 mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准碱液)滴定未知浓度的酸用去碱液22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,由收集的500mLNO2气体求得NO2气体的物质的量为(0.5/22.4) mol
难度: 简单查看答案及解析
-
磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确的是( )
 A.HPO42-中含有共价键,其中P的化合价为+5价
A.HPO42-中含有共价键,其中P的化合价为+5价B.是一种离子化合物,其中铵根离子的电子式为
C.该化合物中所有原子均满足8电子稳定结构
D.其中P元素的质量分数比N元素的质量分数高
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
①lmolCH3CH2C(CH3)3所含甲基个数为4NA
②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA
④8.8g乙酸乙酯中含共用电子对数为1.4NA
⑤标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
⑥常温常压下,17g甲基(一14CH3)所含的中子数为9NA
⑦标准状况下,11.2L氯仿中含有C—Cl键的数目为1.5NA
⑧lmolC15H32分子中含碳碳键数目为14NA
A.①③⑤⑦ B.②③⑥⑧ C.①②④⑧ D.①②⑥⑧
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.晶体中只要有阳离子就会有阴离子
D.电子数相同的阳离子和阴离子一定不具有相同的质子数
难度: 简单查看答案及解析
-
下列实验能达到预期目的是( )
A.从含I-的溶液中提取碘:加入硫酸酸化的H2O2溶液,再用酒精萃取
B.检验溶液中是否一定含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
C.检验蔗糖水解产物是否具有还原性:向水解后的溶液中加入新制Cu(OH)2并加热
D.除去粗盐中的Ca2+、SO42-:依次加入过量BaCl2溶液、Na2CO3溶液,过滤后再加
适量盐酸
难度: 简单查看答案及解析
-
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的。下列推断中正确的是( )
A.Z的氢化物的热稳定性强于w的氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的离子半径依次增大
D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应
难度: 简单查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是( )
①酸性溶液中:Fe2+,Al3+,NO3-,I-,S2-
②在pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③由水电离的c(H+)=1×10-13mol/L的溶液中:Cl-,HCO3-,NO3-,NH4+,S2O32--
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使甲基橙变红的溶液中:Fe3+,MnO4-,NO3-,Na+,SO42-
⑥无色溶液中:K+,Cl-,Na+,H2PO4-,PO43-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
难度: 简单查看答案及解析
-
在标准状况下,将密度为(10/7)g/L CO2和CO混合气体充满一盛有足量Na2O2的密闭容器中(容积为22.4L,固体体积忽略不计),用间断的点火花引发至充分反应,下列对反应完全后容器里残留物的叙述正确的是( )
A.有0.15molO2 B.有1molNa2CO3
C.有0. 5moCO D.有0.25molNa2CO3
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向含1mol碘化亚铁的溶液中通入标况下44.8L氯气:
2Fe2++2I-+2Cl2=2Fe3++2I2+4Cl-
B.铝铵矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C.H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
D.NaHCO3溶液水解的离子方程式为: HCO3-+H2O
CO32-+H3O+
难度: 简单查看答案及解析
-
下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3 B.4:3 C.2:1 D.3:1
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入NaNO3固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
难度: 简单查看答案及解析
-
已知化学反应N2+ O2=2NO的能量变化如图所示,判断下列叙述中正确的是( )

A.该反应为放热反应
B.该反应每生成2 mol NO,吸收b kJ热量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应吸收
热量时,参加反应的O2为0.5 mol
难度: 简单查看答案及解析
-
经测定某溶液中只含有Na+、CH3COO—、H+、OH—四种离子,且离子浓度大小顺序
为c(CH3COO—)>c(Na+) >c(H+) >c(OH—),其可能的情形是( )
A.该溶液是CH3COONa和CH3COOH的混合溶液
B.该溶液是CH3COONa溶液
C.该溶液是CH3COONa和NaOH的混合溶液
D.向该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO—)>c(Na+) >c(OH—) >c(H+)
难度: 简单查看答案及解析
-
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推知该溶液中( )
A.一定含有I-,不能确定是否含有Cl-
B.一定含有NO3-
C.不含有Fe3+,可能含有NO3-
D.一定含有I-、NO3-和Cl-
难度: 简单查看答案及解析
-
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是( )
A.35.5a=(W2-W1)V2 B. n(Al)>
mol
C.n(Na)+3n(Al)=
mol D. aV2=
难度: 简单查看答案及解析
-
往100mL pH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为( )
A.0.02molB.0.08mlC.0.10molD.0.16mol
难度: 简单查看答案及解析
-
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )

A.曲线A是向NaAlO2溶液中滴入盐酸至过量
B.曲线B是向澄清石灰水中通入CO2至过量
C.曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶 液至过量
D.曲线D是向含有等物质的量的Ca(OH)2、KOH通入CO2至过量
难度: 简单查看答案及解析
-
已知A、B为单质,C为化合物。能实现上述转化关系的是( )
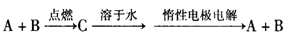
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
难度: 简单查看答案及解析
-
一定质量的铁和铜的混合物,与一定浓度的硝酸反应后容器中没有固体剩余,生成标准状况下2.24LNO和4.48LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是( )
A.0.5 mol B.0.8 mol C.1.0 mol D.1.6 mol
难度: 简单查看答案及解析
-
室温下,下列图形与实验过程相符合的是( )
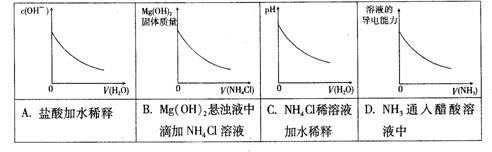
难度: 简单查看答案及解析
-
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是( )

A.a是Fe(NO3)2 B.n1 = 0.375
C.p = 0.20 D.n2 = 0.30
难度: 简单查看答案及解析