-
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol
D.S2O32-是还原剂难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.CO2的电子式:
B.Cl-的结构示意图:
C.化学式NaCl既能表示物质的组成,又能表示物质的一个分子
D.质量数为37的氯原子Cl
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.在含有4molSi-O键的石英晶体中,氧原子数目为4NA
B.在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3NA
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数小于0.1NA难度: 中等查看答案及解析
-
能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10-13 mol/L时又一定能发生反应的离子组是( )
①Na+、Ba2+、Cl-、HCO3- ②K+、NH4+、CH3COO-、SO42-
③Ca2+、Cu2+、NO3-、SO32- ④Fe3+、Na+、SCN-、Cl-
⑤Al3+、Na+、HCO3-、NO3- ⑥Fe2+、Na+、NO3-、I-
⑦Ag+、NH4+、OH-、NO3- ⑧Na+、K+、CH3COO-、NO3-.
A.①②⑥
B.②③⑥
C.①④⑧
D.③⑤⑦难度: 中等查看答案及解析
-
下列关于物质的说法,正确的是( )
A.H2O分子内含有氢键,所以水的熔、沸点比H2S高
B.质量相等的金刚石和石墨晶体中所含的C-C键的数目之比为:4:3
C.晶体中只要有阳离子一定有阴离子
D.非金属氧化物都是分子晶体;构成分子晶体的粒子一定含有共价键难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.将标准状况下112 mL氯气通入10mL 1mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
B.滴有稀硫酸的淀粉碘化钾溶液在空气中变蓝:2I-+O2+4H+═I2+2H2O
C.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O
D.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
A.W的氢化物的稳定性比Y的氢化物的稳定性强
B.X与Z可形成两种氧化物
C.原子半径大小顺序为X<W<Z<Y
D.30g YX2中含有的共价键为1mol难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;
现提供以下化学键的键能:P-P 198KJ•mol-1、P-O 360kJ•mol-1、氧气分子内氧原子间的键能为498kJ•mol-1则P4+3O2═P4O6的反应热△H为( )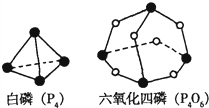
A.+1638kJ•mol-1
B.-1638kJ•mol-1
C.-126kJ•mol-1
D.+126kJ•mol-1难度: 中等查看答案及解析