-
对于任何一个平衡体系,采取以下措施,一定使平衡发生移动的是
A.加入一种反应物 B.增大体系的压强
C.升高温度 D.使用催化剂
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
B.影响化学平衡常数的因素是温度
C.放热反应不一定能自发进行,而吸热反应也可能自发进行
D.熵增大的反应其焓变一定增大,焓变增大的反应其熵不一定增大
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨气的最快的是
A.v(H2)=0.3 mol ·L-1·min-1 B.v(N2)=0.2 mol ·L-1·min-1
C.v(NH3)=0.25 mol ·L-1·min-1 D.v(H2)=0.4 mol ·L-1·min-1
难度: 中等查看答案及解析
-
向稀氨水中加入下列物质,能使溶液中的铵根离子浓度减小、pH增大的是
A.水 B.氨气 C.氢氧化钠固体 D.氯化铵固体
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是
A.CH3COOH +H2O
CH3COO- + H3O+ B.SO2 + H2O
HSO3- + H+
C.HS- + H2O
S2- + H3O+ D.CO32- + H2O
HCO3- + OH-
难度: 中等查看答案及解析
-
常温下,柠檬水溶液的pH是3,其中的c(OH-)是
A.0.1mol/L B.10-3 mol/L C.10-7 mol/L D.10-11 mol/L
难度: 简单查看答案及解析
-
在恒温条件下,能使 A(g)+ B(g)
C(g) + D(g)正反应速率增大的措施是
A.减小C 或D 的浓度 B.增大压强
C.减小B 的浓度 D.增大 A 或B的浓度
难度: 简单查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g) + Y(g)
2Z(g),△H<0,下列叙述正确的是
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率:v正(X) = 2v逆(Z)
C.达到平衡后,降低温度,正反应速率减小的倍数小于逆反应减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该平衡向逆反应方向移动
难度: 中等查看答案及解析
-
恒温下,反应aX(g)
bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的
,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是
A.a>b+c B.a=b+c C.a<b+c D.a=b=c
难度: 中等查看答案及解析
-
为了除去氯化镁酸性溶液中的铁离子,可在加热的条件下加入一种试剂,再向滤液中加入适量的盐酸,这种试剂是
A.NH3•H2O B.Mg(OH)2 C.Na2CO3 D.MgCO3
难度: 中等查看答案及解析
-
在一密闭容器中进行如下反应:2SO2(g)+O2(g)
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A.SO2为0.4mol/L、O2为0.2mol/L B.SO3为0.4mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.25mol/L
难度: 中等查看答案及解析
-
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
A.1 : 1 B.2 : 1 C.1 : 10 D.10 : 1
难度: 困难查看答案及解析
-
下列说法正确的是
A.水的电离方程式:H2O = H+ + OH-
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
难度: 中等查看答案及解析
-
在恒容密闭容器中发生反应2NO2
2NO+O2,下列所述可以说明反应达到平衡状态的是
A.单位时间内生成n molO2的同时生成2n molNO
B.混合气体的平均相对分子质量不再改变
C.混合气体的颜色不再改变
D.混合气体的密度不再改变
难度: 中等查看答案及解析
-
可逆反应2A(g)
B(g)(△H<0)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
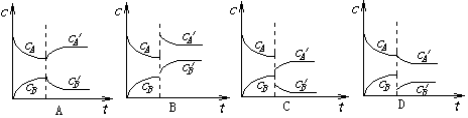
平衡移动的因素:①升高温度 ②降低温度 ③增大压强 ④减小压强
⑤减小生成物B的浓度 ⑥增加反应物的浓度
平衡移动的方向:①正反应方向移动 ②逆反应方向移动 ③不移动
序号
平衡移动的因素(填序号)
平衡移动的方向(填序号)
A
B
C
D
难度: 困难查看答案及解析