-
甲元素原子的核电荷数为11,乙元素的质子数为8,甲和乙化合形成化合物丙,下列说法中错误的是( )
A. 甲形成+1价阳离子 B. 丙一定与水反应
C. 丙一定是MO型离子化合物 D. 丙中含有离子键
难度: 中等查看答案及解析
-
在原子中,下列关系一定正确的是( )
A. 核内质子数=核电荷数
B. 原子序数=最外层电子数
C. 质子数>中子数
D. 原子序数=中子数
难度: 简单查看答案及解析
-
、下列离子方程式书写正确的是( )
A. 向氢氧化钠溶液中通入足量二氧化碳:OH﹣+CO2===HCO3-
B. 氧化钠投入水中发生反应:O2﹣+H2O===2OH﹣
C. 硝酸银溶液中加入铜粉:Ag++Cu===Cu2++Ag
D. 金属铁溶于稀硫酸中:2Fe+6H+===2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+
B. 能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3-
C. 取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42-
D. H++OH-===H2O可描述所有酸碱中和反应的实质
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. NH3易液化,液氨常用作制冷剂
B. 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D. 稀HNO3和活泼金属反应时得不到氢气
难度: 中等查看答案及解析
-
由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Zn
难度: 中等查看答案及解析
-
胶体区别于其他分散系的本质特征是( )
A. 胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B. 产生丁达尔现象
C. 分散质粒子直径在1nm~100nm之间
D. 胶体在一定条件下能稳定存在
难度: 简单查看答案及解析
-
下列物质中都含有氢元素,其中属于酸的是( )
A. NH3 B. CH4 C. NaHCO3 D. HClO3
难度: 中等查看答案及解析
-
下列关于硫的叙述中不正确的是( )
A. 在自然界中既有化合态的硫又有能以游离态的形式存在的硫
B. 游离态的硫存在于火山喷口附近或地壳的岩层里
C. 实验室常用酒精除去附着在试管壁上的硫黄
D. 硫是黑火药的主要成分之一
难度: 中等查看答案及解析
-
合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大
②一般合金的熔点比它各成分金属的更低
③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A. ①②③⑤ B. ②③④ C. ①②④ D. ①②④⑤
难度: 简单查看答案及解析
-
下列各组离子能大量共存的是( )
A. Na+、Mg2+、
、I﹣ B. H+、
、Fe2+、Br﹣
C.
、K+、
、Cl﹣ D. Na+、S2﹣、Cu2+、
难度: 中等查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O == SO42-+4H++2Fe2+,Cr2O72-+6Fe2++14H+ == 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A. Cr2O72-不能将SO2氧化 B. 还原性:Cr3+>Fe2+>SO2
C. 氧化性:Cr2O72->Fe3+>SO2 D. 两个反应中Fe3+均表现还原性
难度: 中等查看答案及解析
-
设阿伏加德罗常数为NA,标准状况下,mgN2和O2的混合气体含有b个分子,则ng该混合气体在相同状态下的体积为(单位为L)( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
关于金属材料的锈蚀说法不一,其中没有科学道理的是( )
A. 金属接触水和空气锈蚀最快
B. 改变金属的内部结构形成合金能抵御金属锈蚀
C. 金属表面刷油漆可以抵御金属锈蚀
D. 不断擦去铝表面的锈能抵御铝的继续锈蚀
难度: 中等查看答案及解析
-
以下有关氨及铵盐的叙述中,不正确的是( )
A. 铵态氮肥不能与碱性物质,如草木灰混合施用
B. 氨的喷泉实验体现了氨的溶解性和氧化性
C. 实验室常用固体氯化铵与氢氧化钙固体反应制取氨气
D. 氨具有还原性,一定条件下可与氧化性物质,如氧气反应
难度: 中等查看答案及解析
-
下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO2 ②铵盐都不稳定,受热分解都生成氨气 ③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A. ①③④ B. ①③
C. ①④ D. ①②③④
难度: 中等查看答案及解析
-
下列关于氧化还原反应说法正确的是( )
A. 一种元素被氧化,另一种元素肯定被还原
B. 某元素从化合态变成游离态,该元素一定被还原
C. 在反应中不一定所有元素的化合价都发生变化
D. 在氧化还原反应中非金属单质一定是被还原
难度: 中等查看答案及解析
-
下列说法正确的是
A. 只含有共价键的物质属于共价化合物
B. 所有物质中均含有化学键
C. 含有离子键的物质肯定含金属元素
D. 只要含离子键的化合物就属于离子化合物
难度: 简单查看答案及解析
-
下列关于有机化合物的叙述中正确的是( )
A. 仅由碳、氢两种元素组成
B. 仅由碳、氢、氧三种元素组成
C. 分子中碳原子可形成碳碳单键、碳碳双键或碳碳叁键
D. 有机化合物分子中不存在非极性共价键
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同一周期相邻主族的两种元素的原子序数之差是1
B. 同一主族的两种元素的原子序数之差不可能是36
C. 同一主族相邻周期的两种元素的原子序数之差可能是18
D. 同一主族相邻周期的两种元素的原子序数之差都相同
难度: 中等查看答案及解析
-
科研人员最近发现放射性同位素钬
可有效地治疗肝癌。下列关于
的叙述正确的是( )
A. 原子序数是166 B. 质量数是67
C. 中子数是99 D. 电子数是99
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
A. C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
B. 氢氧化钠溶液与盐酸的中和反应
C. 反应物的总能量大于生成物的总能量
D. 破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
难度: 中等查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. 单位时间内消耗a mol A,同时生成3a mol C B. 当3v(B)正 = 2v(C)逆
C. 容器内的压强不再变化 D. 混合气体的物质的量不再变化
难度: 简单查看答案及解析
-
下列各组元素性质递变情况错误的是( )
A. H、Be、B原子最外层电子数依次增多 B. P、S、Cl元素最高正化合价依次升高
C. B、C、N、O、F原子半径依次增大 D. Li、Na、K、Rb的金属性依次增强
难度: 中等查看答案及解析
-
巴豆酸的结构简式为CH3-CH=CH-COOH。现有①氯化氢②溴水 ③纯碱溶液 ④乙醇 ⑤酸性高锰酸钾溶液,试根据据巴豆酸的结构特点,判断在一定的条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤ B. 只有①③④ C. 只有①②③④ D. 全部
难度: 中等查看答案及解析
-
下列叙述中能表明金属甲的活动性比金属乙的活动性强的是( )
A. 在氧化还原反应中,甲失电子数比乙多
B. 同价态阳离子甲比乙氧化性强
C. 甲与盐酸缓慢反应放出氢气,而乙能与冷水剧烈反应放出氢气
D. 甲、乙与硫酸溶液形成原电池,乙上冒气泡
难度: 中等查看答案及解析
-
对于可逆反应M+N
Q达到平衡时,下列说法正确的是
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 正反应和逆反应不再进行
难度: 简单查看答案及解析
-
下列元素的原子在形成不同的化合物中,既能形成离子键,又能形成极性键和非极性键的是
A. K B. Ca C. I D. Ne
难度: 简单查看答案及解析
-
化学反应A2 + B2 = 2AB的能量变化如图所示,则下列说法正确的是( )
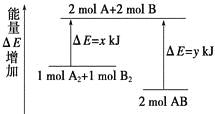
A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
难度: 中等查看答案及解析
-
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4x B. 4x+6 C. 4x+10 D. 4x+14
难度: 中等查看答案及解析