-
下列有关仪器使用方法或实验操作正确的是( )
A. 洗净的锥形瓶和容量瓶可以放进烘箱烘干
B. 酸式滴定管装标准溶液前,必须先用该溶液润洗
C. 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D. 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
难度: 简单查看答案及解析
-
下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5mol H2所占体积为11.2L
③标准状况下,1mol H2O的体积为22.4L
④常温常压下,28g CO与N2的混合气体所含的原子数为2NA
⑤各种气体的气体摩尔体积都约为22.4L•mol﹣1
⑥标准状况下,体积相同的气体的分子数相同.
A.①③⑤ B.④⑥ C.③④⑥ D.①④⑥
难度: 简单查看答案及解析
-
三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
难度: 困难查看答案及解析
-
取100mL 0.3mol•L﹣1和300mL 0.25mol•L﹣1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A.0.21 mol•L﹣1 B.0.56 mol•L﹣1 C.0.42 mol•L﹣1 D.0.26 mol•L﹣1
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A. 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L﹣1
B. 100 g硫酸溶液的物质的量浓度为18.4 mol•L﹣1,用水稀释到物质的量浓度为9.2 mol•L﹣1,需要水100 g
C. 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀
D. 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液
难度: 简单查看答案及解析
-
分类是科学研究的重要方法,下列物质分类不正确的是( )
A.化合物:干冰、冰水共存物、烧碱、小苏打
B.非电解质:乙醇、四氯化碳、氯气、葡萄糖
C.同素异形体:活性炭、C60、石墨烯、金刚石
D.混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉
难度: 简单查看答案及解析
-
2013年冬天,多个地区发生持续大雾天气,“PM2.5”数据监测进入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中错误的是( )
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成的分散系为胶体
C.实施绿化工程,可以有效地防治PM2.5污染
D.烟、雾属于胶体,能产生丁达尔效应
难度: 简单查看答案及解析
-
下表中物质的分类组合完全正确的是( )
选项
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
HF
CaCO3
HClO
CH3COONH4
非电解质
SO2
金属Al
H2O
C2H5OH
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.在硫酸亚铁溶液中加入稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
B.MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)
Mn2++2Cl﹣+Cl2↑+2H2O
C.过量的KHSO4与Ba(OH)2溶液反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D.向稀氢氧化钠溶液中通入少量CO2:OH﹣+CO2═HCO3﹣
难度: 简单查看答案及解析
-
在如图点滴板上有四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
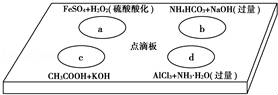
A.a反应:Fe2++2H++H2O2═Fe3++2H2O
B.b反应:HCO3﹣+OH﹣═CO32﹣+H2O
C.c反应:H++OH﹣═H2O
D.d反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
难度: 简单查看答案及解析
-
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3﹣、K+
稀硫酸
3Fe2++NO3﹣+4H+═3Fe3++NO↑+2H2O
B
Fe3+、I﹣、ClO﹣
氢氧化钠溶液
Fe3++3OH﹣═Fe(OH)3↓
C
Ba2+、HCO3﹣、Cl﹣
氢氧化钠溶液
HCO3﹣+OH﹣═CO+H2O
D
Al3+、Cl﹣、NO3﹣
过量氢氧化钠溶液
Al3++3OH﹣═Al(OH)3↓
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO
+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的( )
A.Na2O2既是氧化剂,又是还原剂
B.O2是还原产物,Mn2+是氧化产物
C.通常用浓盐酸酸化高锰酸钾溶液
D.标准状况下,产生22.4 L O2时反应转移2 mol e﹣
难度: 简单查看答案及解析
-
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
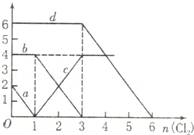
A.d曲线代表溶液中Br﹣变化情况
B.原溶液中FeI2的物质的量为2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
难度: 中等查看答案及解析
-
已知氧化性:Cl2>IO3﹣>Fe3+>I2,以下实验的结论或实验的预测合理的是( )
A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I﹣
B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色
C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有IO3﹣
D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成
难度: 简单查看答案及解析
-
一定条件下,硝酸铵受热分解的化学方程式为:NH4NO3→HNO3+N2+H2O(未配平),该反应中,被氧化与被还原的氮原子个数之比为( )
A.5:3 B.5:4 C.1:1 D.3:5
难度: 中等查看答案及解析
-
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为xmol
D.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol
难度: 简单查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.75 mol
D.被氧化的N原子的物质的量为3.75 mol
难度: 简单查看答案及解析
-
把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A.0.1(b﹣2a) mol•L﹣1
B.10(2a﹣b) mol•L﹣1
C.10(b﹣a) mol•L﹣1
D.10(b﹣2a) mol•L﹣1
难度: 简单查看答案及解析