-
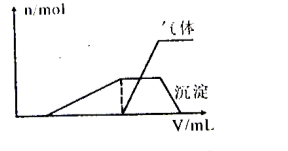
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1 mol/L的NaOH溶液1.0 L,此时溶液呈中性,铜离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2︰l
B. 硝酸的物质的量浓度为2.6 mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
难度: 困难查看答案及解析
-
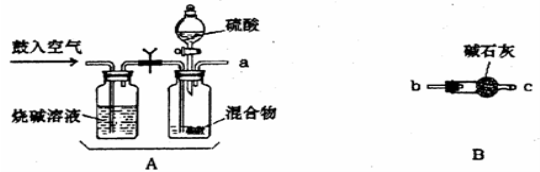
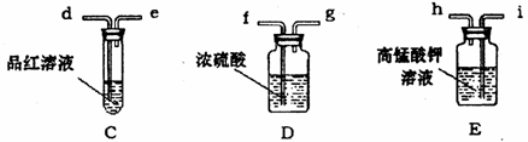
用下列实验装置进行相应实验,能达到实验目的的是
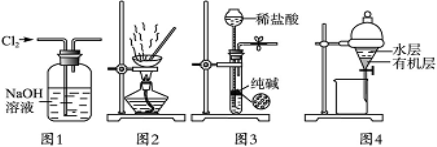
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
下列有关试纸的使用及实验现象的叙述正确的是
A.用湿润的pH试纸测定溶液的pH,所测pH一定不准
B.使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气
C.使湿润的红色石蕊试纸褪色的气体必然是SO2
D.用湿润的红色石蕊试纸检验NH3
难度: 中等查看答案及解析
-
下列变化一定属于化学变化的是
①导电 ②爆炸 ③缓慢氧化 ④SO2使品红溶液褪色 ⑤无水硫酸铜由白变蓝
⑥工业制O2 ⑦白磷转化为红磷 ⑧久置浓硝酸变黄 ⑨16O与18O间的相互转化
A.②③④⑦⑧⑨ B.③④⑤⑦⑧ C.②③⑥⑦⑨ D.④⑤⑥⑧
难度: 简单查看答案及解析
-
下列有关胶体的说法错误的是
A.实验室常用渗析的方法对胶体提纯
B.硅酸胶体中逐滴加入氢氧化钠溶液,先有沉淀生成再看到沉淀溶解
C.所有的胶体均能发生电泳
D.由于土壤胶粒带负电,因此NH4+的肥效比NO3-高
难度: 简单查看答案及解析
-
某化学兴趣小组同学对有关物质的分类进行讨论辨析:①生铁、氯水都属于混合物 ②AlCl3溶液、蛋白质溶液都属于溶液 ③SiO2、CO都属于酸性氧化物 ④含氢原子的盐不一定属于酸式盐。上述说法中正确的是
A.①② B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列两种气体的分子数一定不相等的是
A.质量相等密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温、等压,等体积的O2和N2 D.常温常压下,等质量的NO和CO
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
C2H5OH(l)
H2O(l)
新制的生石灰
蒸馏
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Al3+、Cl-、Na+、HCO3-、SO42-
②pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
③加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
④使pH试纸呈红色的溶液中:Fe3+、MnO4-、Na+、SO42-
⑤酸性溶液中:Fe2+、Al3+、NO3-、I-
A.①②④ B.①⑤ C.②③④ D.①②③
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3· H2O+SO2===2NH4++SO32-+H2O
B.固体氯化钠与浓硫酸混合加热:H2SO4+2Cl-===SO2↑+Cl2↑+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-===3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-==2BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法错误的是
A.1 mol
OD- 含有的质子、中子数均为9NA
B.3.6 g石墨和C60的混合物中,含有的碳原子数为0.3NA
C.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA
D.标准状况下,4.48 L HF含有的分子数为0.2NA
难度: 中等查看答案及解析
-
以下数值大于或等于阿伏加德罗常数的是
A.4.8g石墨中的共价键数目
B.250 mL 1 mol·L-1FeCl3溶液中,阴、阳离子总数
C.一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数
D.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数
难度: 中等查看答案及解析
-
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为
A.1∶6 B.1∶7 C.2∶11 D.16∶25
难度: 困难查看答案及解析
-
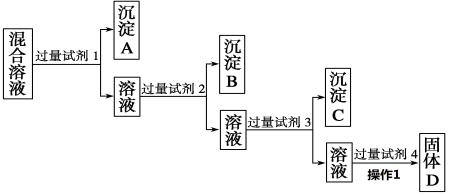
有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同, M溶液里的阳离子只有两种,则N溶液里的阴离子可能是
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
实验操作
实验目的或结论
A
某钾盐溶于盐酸,产生能使澄清石灰水
变浑浊的无色无味气体
说明该钾盐是K2CO3
B
向含有少量FeCl3的MgCl2溶液中加入足量
Mg(OH)2粉末,搅拌一段时间后过滤
除去MgCl2溶液中
少量FeCl3
C
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
说明常温下
Ksp(BaCO3)< Ksp(BaSO4)
D
C2H5OH与浓硫酸170 ℃共热,制得的气体
通入酸性KMnO4溶液
检验制得气体是
否为乙烯
难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有
①
②
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中加入等质量的水后,所得溶液的物质的量浓度大于0.5C
A. ②③ B. ①③ C. ②④ D. ③④
难度: 困难查看答案及解析