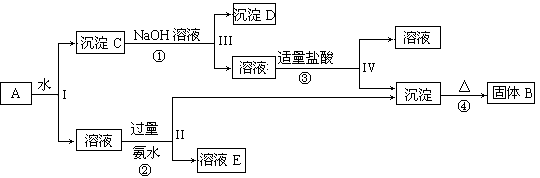
-
设NA为阿伏加德罗常数,则下列说法正确的是( )
A.1mol FeCl3形成的 Fe(OH)3胶体中,胶体的颗粒为NA
B.标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L
C.1molNa2O2与水反应时转移电子数约为NA
D.含1molHCl的浓盐酸与足量MnO2反应可制得0.25molCl2
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
难度: 中等查看答案及解析
-
关于化学反应中的能量变化,下列说法中不正确的是( )
A.燃烧反应都是放热反应
B.对于可逆反应:aA(g)+bB(g)
bC(g)+dD(g),如果正反应放热,逆反应一定吸热
C.氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量
D.只有放热的氧化还原反应才可以设计为原电池
难度: 中等查看答案及解析
-
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH
NO
CO
Na+ B.Na+ Ba2+ Mg2+ HCO
C.NO
K+ AlO
OH- D.NO
Mg2+ K+ Cl-
难度: 中等查看答案及解析
-
通常情况下,下列操作错误的是( )

难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.
与
得电子能力相同
难度: 中等查看答案及解析
-
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2
难度: 中等查看答案及解析
-
下列过程中,没有发生化学变化的是( )
A.干冰用于人工降雨
B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C.溶洞中钟乳石的形成
D.豆科作物的根瘤菌对空气中氮的固定
难度: 中等查看答案及解析
-
下列分类不正确的是( )
A.纯碱、烧碱均属碱类 B.CO2、SiO2、SO2均属酸性氧化物
C.醋酸、硫酸、硝酸均属酸类 D.Na2CO3、Na2SO3、NaCl都属钠盐
难度: 简单查看答案及解析
-
下列实验方案设计中,可行的是( )
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物
D.将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气
难度: 中等查看答案及解析