-
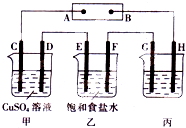
室温下,甲溶液中水电离出的H+浓度为10-12 mol•L-1,乙溶液中水电离出的H+浓度为10-2 mol•L-1,下列说法中正确的是( )
A.甲、乙两溶液的pH不可能相同
B.甲、乙两种溶液中加入Al粉都会产生H2
C.HCO3- 不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液难度: 中等查看答案及解析
-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极难度: 中等查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.25°C时,pH=13的1L Ba(OH)2溶液中含有OH-数目为0.1NA
B.200mL 5mol•L-1Na2S溶液中,含NA个S2-
C.常温下,pH=12的1L氨水中含有的NH3•H2O分子数是0.01 NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g难度: 中等查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1mol Na2Mn5O10转移2mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②常温下pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol•L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Al3+、Cl-、S2-
⑥使pH试纸呈红色的溶液中:Fe2+、Al3+、NO3-、Cl-.
A.②④
B.③⑤
C.④⑥
D.②⑤难度: 中等查看答案及解析
-
下列各组比较中,前者比后者大的是( )
A.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度难度: 中等查看答案及解析
-
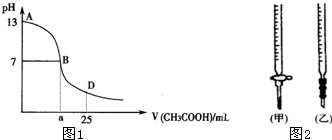
现有常温下pH=3的醋酸和pH=3的硫酸两种溶液,下列叙述正确的是( )
A.两溶液中水电离出的c(H+)均为1×10-11 mol•L-1
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的c (CH3COO-) 和硫酸中的c (SO4 2- )相同]
D.等体积的两溶液中分别加入足量锌片时放出H2的体积相同难度: 中等查看答案及解析
-
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-.下列说法正确的是( )
A.加入少量NaOH固体,c(CH3COO-) 减小
B.升高温度,溶液的pH增大
C.稀释溶液,溶液的pH增大
D.通入少量HCl气体,水解平衡常数减小难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol•L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.0.1 mol•L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)难度: 中等查看答案及解析
-
在BaSO3(s)⇌Ba2+(aq)+SO3 2- (aq)平衡体系中,下列措施可使沉淀量减少的是( )
A.加入K2SO3(s)
B.加入稀HNO3
C.加入稀盐酸
D.加入K2SO4(s)难度: 中等查看答案及解析
-
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),在常温下KSP=2×10-20mol3/L3.在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于( )
A.2
B.3
C.4
D.5难度: 中等查看答案及解析
-
用惰性电极电解M(NO3)x的水溶液,当阴汲上增重ag时,在阳极上同时产生bL氧气(标准状况〕:从而可知M的原子量为( )
A.22.4ax/b
B.11.2ax/b
C.5.6ax/b
D.2.5ax/b难度: 中等查看答案及解析
-
1L 1mol•L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断中不正确的是( )
A.溶液的浓度仍为 1 mol•L-1
B.阳极上产生112 mL (标准状况下) O2
C.转移的电子数约为1.204×1022个
D.反应中有0.02 mol金属被氧化难度: 中等查看答案及解析
-
关于下列装置的说法中正确的是( )
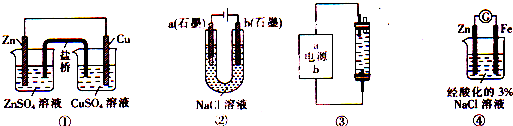
A.装置①盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH减小
C.用装置③制作一个简易的消毒液发生器,其中b为正极,电解质为饱和氯化钠溶液
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成难度: 中等查看答案及解析