-
化学与生产、生活密切相关。下列叙述正确的是
A. 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
B. 天然纤维和合成纤维的主要成分都是纤维素
C. 海水淡化的方法有蒸馏法、电渗析法等
D. 煤的干馏和煤的液化均是物理变化
难度: 简单查看答案及解析
-
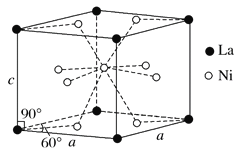
已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大, Y元素的原子最外层电子数为m,次外层电子数为n,Z 元素的原子L层电子数为m+n, M层电子数为m-n,W与Z同主族,R 元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是
A. Y的氢化物比R的氢化物稳定,且熔沸点高
B. RY2、WY2通入BaCl2溶液中均有白色沉淀生成
C. Z、W、R 最高价氧化物对应水化物的酸性:R>W>Z
D. X 与Y 形成的两种化合物中阴、阳离子的个数比均为1∶2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1mol 有机物
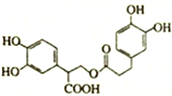 在一定条件下能和7mol NaOH 反应
在一定条件下能和7mol NaOH 反应B.
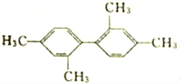 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上C. 分子式为C4H7ClO2,可与NaHCO3 产生CO2的有机物的结构可能有3 种
D. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
难度: 中等查看答案及解析
-
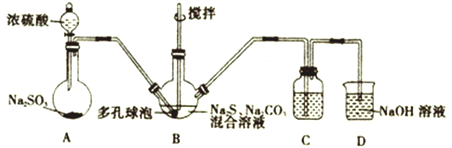
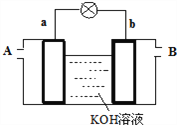
最近有研究人员发现了一种处理高浓度乙醛废水的新方法一隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4 溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是
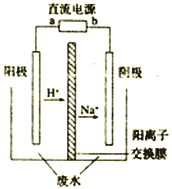
A. 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
B. 阳极反应为CH3CHO-2e-+2H+=CH3COOH+H2O
C. 电解过程中,阴极区Na2SO4的物质的量增大
D. 若以CH4—空气燃料电池为直流电源,燃料电池的b 极应通入空气
难度: 中等查看答案及解析
-
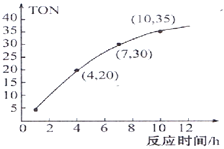
向密闭容器中充入物质的量浓度均为0.1 mol•L-1的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g)
2CO(g)+2H2(g),测得CH4 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
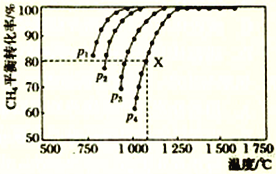
A. 随着温度升高,该反应的平衡常数减小
B. 1100℃,p4条件下,该反应10min时达到平衡点X,则v(CO2)=0.008 mol·L-1·min-1
C. p1、p2、p3、p4大小的顺序为p1<p2<p3<p4
D. 平衡时CO 与H2的物质的量比为1∶1
难度: 中等查看答案及解析
-
下列不能达到实验目的的是
序号
实验内容
实验目的
A
用石墨电极电解Mg(NO3)2、Cu( NO3)2 的混合液
比较确定铜和镁的金属活动性强弱
B
测同温同浓度Na2CO3和Na2SiO3水溶液的pH
确定碳和硅两元素非金属性强弱
C
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
难度: 中等查看答案及解析
-
常温下,用0.10 mol·L-1NaOH 溶液分别滴定20.00mL 浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是
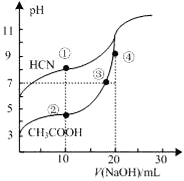
A. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
难度: 困难查看答案及解析