-
在具有下列电子排布式的原子中,原子半径最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
难度: 中等查看答案及解析
-
下列电子式书写错误的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 处于最低能量状态的原子叫基态原子
B. 2p3表示2p能级上有3个p轨道
C. 核外电子分层排布规律表明,多电子原子核外电子总是按能层次序从低到高依次填充
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
元素周期表中,按照第一电离能由大到小顺序排列错误的是( )
A. Be、Mg、Ca B. Mg、Ca、K C. He、Ne、Ar D. O、N、C
难度: 中等查看答案及解析
-
在元素周期表中,同周期的X、Y、Z三种元素,其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 原子半径:X>Y>Z B. 简单阴离子半径:X->Y2->Z3-
C. 气态氢化物稳定性:X<Y<Z D. 电负性:X>Y>Z
难度: 困难查看答案及解析
-
与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C—C≡N,下列说法不正确的是( )
A. 其中叁键的键长比单键要短 B. 分子中含3个σ键和4个π键
C. 分子构型为直线形 D. 可以发生加成反应,但不能与氢氧化钠溶液反应
难度: 困难查看答案及解析
-
根据已有化学知识及经验,判断下列关系中不正确的是( )
A. 分子的极性大小排序:CH4<HBr<HCl<HF
B. 原子半径大小排序:O<S<Na<K
C. 热稳定性强弱排序:CaCO3>Na2CO3>NaHCO3>H2CO3
D. 金属熔点由高到低排序:W>Cu>Na>Hg
难度: 困难查看答案及解析
-
元素周期表中几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、 -2
+2
-2
下列叙述正确的是( )
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)2-)
④L2+和X2-的核外电子数相等
A. ①④ B. ①③ C. ②④ D. ①②③
难度: 困难查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形
B. V形;三角锥形
C. 直线形;平面三角形
D. V形;平面三角形
难度: 中等查看答案及解析
-
由下列物质构成的晶体中,同时存在极性键、非极性键和氢键的是( )
A. CO2 B. H2O2 C. H2O D. C2H2
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
难度: 中等查看答案及解析
-
下列关于配合物的说法不正确的是( )
A. 硫酸铜的水溶液中,铜离子实际上主要以四水合铜离子的形式存在
B. 氯化银沉淀能溶于氨水,说明有的配合物(或配离子)很稳定
C. 金属离子都能作为中心离子,含有孤对电子的分子(或离子)都可作配体
D. 硫氰合铁(III)离子呈血红色,由此可用KSCN溶液检验Fe3+离子
难度: 中等查看答案及解析
-
下列客观事实与氢键无关的是( )
A. 冰的密度比水小 B. H2O的分解温度比H2S高得多
C. 液态氟化氢中有三聚氟化氢 D. NH3的沸点比PH3高
难度: 中等查看答案及解析
-
下列说法正确的是
①具有规则几何外形的固体不一定是晶体;②含有阳离子的晶体一定是离子晶体;③非极性分子中一定含有非极性键;④s-s σ键与s-p σ键的电子云形状相同;⑤含有共价键的晶体一定具有高的熔、沸点及硬度;⑥因为H—F的键能大于H—Cl的键能,所以HF的沸点高于HCl;⑦含有π键的化合物与只含σ键的化合物的化学性质不同;⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
A. ①②⑤⑥ B. ③⑦⑧ C. ①⑦⑧ D. ③④⑤⑧
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 手性异构体性质相同 B. 互为手性异构体的分子互为镜像
C. 手性异构体分子组成相同 D. 手性催化剂只催化或主要催化一种手性分子的合成
难度: 中等查看答案及解析
-
有三种短周期的元素分别为X、Y和Z,已知X元素的原子价电子排布式为ns1,Y元素原子的K层电子是L层电子数的一半,Z元素原子K电子层上的电子数是L电子层上电子数的1/3,则这三种元素所组成的化合物的分子式不可能是( )
A. X2YZ B. X2YZ2 C. X2YZ3 D. X2YZ4
难度: 中等查看答案及解析
-
下面的排序不正确的是
A. 熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
难度: 中等查看答案及解析
-
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
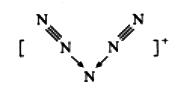
A. 每个N5+中含有35个质子和36个电子 B. 该离子中只含有非极性键
C. 该离子中含有2个π键 D. N5+与PO43-互为等电子体
难度: 中等查看答案及解析
-
下列不能形成配位键的组合是( )
A. Ag+、NH3 B. BF3、NH3 C. Co3+、CO D. Ag+、H+
难度: 简单查看答案及解析
-
下列晶体熔化时不需破坏化学键的是( )
A. 晶体硅 B. 氯化钠固体 C. 金属钾 D. 干冰
难度: 中等查看答案及解析
-
已知磷酸分子(
 )中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此推断出H3PO2的分子结构是( )
)中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此推断出H3PO2的分子结构是( )A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A. 磷化硼晶体中每个原子均形成4条共价键
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体的熔点很低
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠晶体相同
难度: 困难查看答案及解析
-
硼和镁形成的化合物可刷新金属化合物超导温度的最高记录。下图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )

A. Mg3B2 B. MgB2 C. Mg2B3 D. Mg2B
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 足量的Cu与含有0.2molH2SO4的浓硫酸共热可生成SO2为0.1NA
B. 标准状况下,22.4LCCl4中含有的分子数目为NA
C. 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA
D. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为 0.2NA
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
难度: 中等查看答案及解析