-
19世纪中叶,门捷列夫的突出贡献是
A.提出原子学说 B.发现元素周期律 C.提出分子学说 D.发现氧气
难度: 简单查看答案及解析
-
1996年2月,德国某研究所在高能加速器中,将
Zn撞入一个
Pb的原子核并释放出一个中子后,合成一种人造超重元素的原子。该元素原子内中子数为
A.278 B.277 C.166 D.165
难度: 简单查看答案及解析
-
最近,医药界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖。有关14C的正确叙述是
A.与12C60中的碳原子化学性质不同 B.与14N含的中子数相同
C.是12C60的同素异形体 D.与12C、13C互为同位素
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是
A.葡萄糖在人体内氧化分解 B.氢气在氧气中燃烧
C.碳酸钙高温分解成氧化钙和二氧化碳 D.氢氧化钾和硫酸中和
难度: 简单查看答案及解析
-
患甲状腺肿大是边远山区常见的地方病,下列元素对该病有治疗作用的是
A.钠元素 B.氯元素 C.碘元素 D.铁元素
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被活性炭吸附
C.葡萄糖溶于水 D.HCl气体溶于水
难度: 简单查看答案及解析
-
已知A的质子数是x,B2-与A3+具有相同的电子层结构,则B元素的质子数为
A.x+5 B.x-5 C.x+1 D.x-1
难度: 简单查看答案及解析
-
关于下列图示的说法中,正确的是:
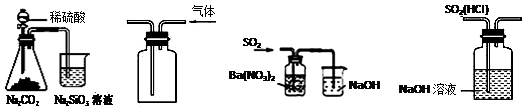
① ② ③ ④
A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③所示实验装置制备BaSO3沉淀
D.图④装置可以用来除去SO2中的HCl
难度: 简单查看答案及解析
-
自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变质问题的是
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
难度: 简单查看答案及解析
-
下列气体不能用排水集气法收集的是
A.NO B.NH3 C.O2 D.CO
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.氨气通入醋酸溶液 CH3COOH+NH3 == CH3COONH4
B.澄清的石灰水跟盐酸反应 HCl+OH-== H2O+Cl-
C.碳酸钙溶于醋酸 CaCO3+2H+ == Ca2++H2O+CO2↑
D.金属钠跟水反应 2Na+2H2O == 2Na++2OH-+H2↑
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A.H+ 、Na+、CO32-、Cl- B.Ag+、Al3+、NO3-、H+
C.K+、H+、SO42-、OH- D.Ba2+、Na+、Cl-、SO42-
难度: 简单查看答案及解析
-
在实验室中,对下列事故或药品的处理正确的是
A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.含硫酸的废液倒入水槽,用水冲入下水道
难度: 简单查看答案及解析
-
下列说法中正确的是
A.人类历史上使用最早的合金是生铁
B.目前世界上使用量最大的合金是铝合金
C.目前世界上用途最广的合金是钢
D.合金比纯金属更适合做导线
难度: 简单查看答案及解析
-
下列有关比较中正确的是
A.酸性: H3PO4 > HNO3 B.稳定性: HBr > HCl
C.金属性: Na > K D.非金属性: Cl > S
难度: 简单查看答案及解析
-
对于放热反应2H2+O2 ==== 2H2O,下列说法正确的是
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和02具有的能量相等
难度: 简单查看答案及解析
-
将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是
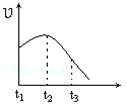
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的主要原因是随着反应的进行镁体积减少
D.从t2→t3的主要原因是随着反应的进行温度越来越低
难度: 简单查看答案及解析
-
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
难度: 简单查看答案及解析
-
已知空气-锌电池的电极反应为:
锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2+2H2O +4e-=4OH-
根据此判断,锌片是:
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变⑤混合气体的密度不再改变
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
难度: 简单查看答案及解析
-
某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,该金属可能为
A.铝 B.铜 C.锡 D.硅
难度: 简单查看答案及解析
-
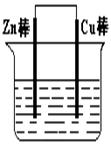
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
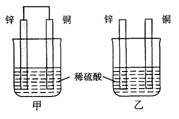
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
难度: 简单查看答案及解析
-
检验SO2中是否混有CO2气体,可采用的方法是
A.通过品红溶液,若品红溶液褪色,则说明混有CO2气体
B.通过澄清石灰水,若变混浊,则说明混有CO2气体
C.先通过足量NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体
D.先通过足量KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变混浊,则说明混有CO2气体
难度: 简单查看答案及解析
-
已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3 B.Ba(NO3)2 C.Na2SO4 D.KCl
难度: 简单查看答案及解析
-
检验试管中盛有的少量白色固体是铵盐的方法是
A.加NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝
B.将固体加热,将产生的气体通入紫色石蕊试液,看是否变红
C.加水溶解,用pH试纸测溶液的酸碱性
D.加入NaOH溶液,加热,再滴入酚酞试液
难度: 简单查看答案及解析
-
下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl3
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量98%浓硫酸 D.不用铁片,改用同质量的铁棒
难度: 简单查看答案及解析
-
下列过程属于“氮的固定”的是
A.合成氨工业中将氮气与氢气化合生成氨气
B.N2和O2经放电生成NO
C.通过加压、降温等方法将氮气转变为液态氮
D.NH3被H2SO4硫酸吸收生成(NH4)2SO4
难度: 简单查看答案及解析
-
下列物质中,既有离子键,又有有共价键的是
A.HCl B.KOH C.CaCl2 D.NH4 NO3
难度: 简单查看答案及解析
-
右图是可逆反应X2 + 3Y2
2Z2 在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
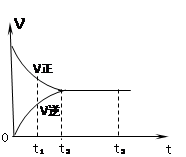
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
难度: 简单查看答案及解析