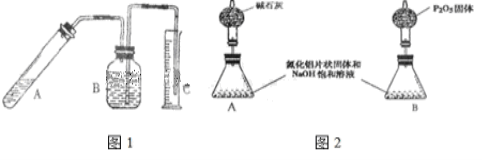
-
下列仪器:①烧杯②坩埚③锥形瓶④蒸发皿⑤试管⑥烧瓶⑦表面皿,用酒精灯加热时,不需要垫石棉网的是 ( )
A. ②④⑤ B. ②④⑦ C. ④⑥⑦ D. ①③⑥
难度: 简单查看答案及解析
-
①用稀硝酸清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用热的浓盐酸清洗残留二氧化锰的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用热的氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断正确的是 ( )
A. 全都正确 B. 除④外都对 C. 除⑤外都对 D. ④⑤不对
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
B. 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
C. 用10 mL量筒量取9.2 mL NaCl溶液
D. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液
难度: 简单查看答案及解析
-
下列操作中错误的是( )
A.除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液
B.除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥
C.除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶
D.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
难度: 中等查看答案及解析
-
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
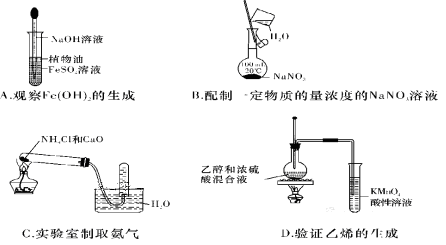
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量的气体所占的体积,其单位是L
④同温同压下,气体的密度与气体的相对分子质量成正比
⑤在同温同体积时,气体的物质的量越大,则压强越大
⑥蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑦标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解
A.①⑤⑥⑦ B.①②④⑤ C.①②⑥⑦ D.②③④⑤
难度: 中等查看答案及解析
-
下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和硝酸银用棕色试剂瓶保存
B.常温下铁和铂都不溶于浓硝酸
C.亚硫酸盐和硫酸亚铁固体长期暴露在空气中变质
D.H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A.由2H和18O所组成的水22g,其中所含的中子数为12 NA
B.分子数为NA的N2、CO混合气体体积在标况下为22.4 L,质量为28 g
C.标准状况下,22.4LNO和11.2L O2混合后气体的分子总数为NA
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
难度: 困难查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识
进行分类,其中甲与乙
、丙、丁是包含关系。下列各组中,正确的组合是( )
选项
甲
乙、丙、丁
A
纯净物
液氯、水玻璃、明矾
B
非电解质
冰醋酸、SO2、乙醇
C
弱电解质
CH3COOH 、氨水、H2O
D
碱性氧化物
CaO、Na2O、K2O
难度: 中等查看答案及解析
-
某溶液既能溶解Al(OH)3,又能溶解H2S
iO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+
难度: 中等查看答案及解析
-
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
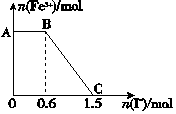
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.15 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1∶6
难度: 困难查看答案及解析
-
在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=
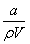 ×100%
×100%B.溶质的物质的量浓度c=
mol·L-1
C.溶液中c(OH-)=
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
难度: 困难查看答案及解析
-
下列离子方程式的书写及评价,均合理的是( )
选项
离子方程式
评价
A
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O
正确,Fe2+与Fe3+物质的量之比为1:2
B
Ba(HCO3)2溶液与足量的NaOH溶液反应
Ba2++HCO3-+OH-=BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO-=HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:
2AlO2-+5H+=Al3++Al(OH)3↓+H2O
正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3
难度: 困难查看答案及解析
-
已知NH4CuSO3与足量的3 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法错误的是( )
A.NH4CuSO3中只有Cu元素被氧化
B.反应中硫酸作氧化剂
C.刺激性气味的气体是二氧化硫
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
难度: 困难查看答案及解析
-
某无色溶液中可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。

下列结论不正确的是( )
A.肯定没有的离子是② B.不能确定的离子是③⑥
C.肯定含有的离子是①③④⑤ D.肯定含有的离子是①④⑤
难度: 困难查看答案及解析
-
从下列事实所列出的相应结论正确的是( )
实 验 事 实
结 论
①
SO2使酸性高锰酸钾溶液退色
可证明SO2有漂白性
②
用磨口玻璃瓶保存NaOH溶液,用热的纯碱溶液清洗容器里附
有的油污
都发生了氧化还原反应
③
取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解,
证明Na2SO3已氧化变质
④
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成
确定该溶液存在CO32-
⑤
某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液一定有NH4+
A.①② B.③④ ⑤ C. ②④ D.④ ⑤
难度: 困难查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
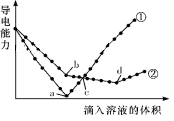
A.②代表滴加H2SO4溶液的变化曲线
B.b点溶液中大量存在的离子是SO42-、Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点两溶液中含有相同量的OH-
难度: 困难查看答案及解析
-
一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法正确的是( )
A.该合金中铁的质量为5.4 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA
D.所加的稀硫酸中含0.6 mol H2SO4
难度: 困难查看答案及解析