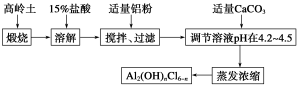
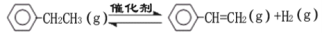
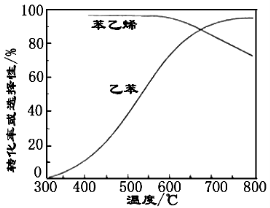
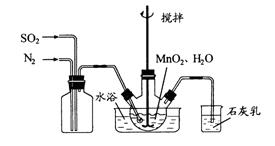
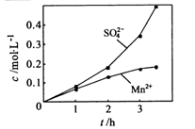
-
下列实验或生产操作,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀 ②将饱和氯水滴到蓝色石蕊试纸上
③二氧化氮经加压凝成无色液体 ④溴水滴入植物油中振荡褪色
⑤胆矾风化 ⑥除去混在氢氧化铁胶体中的氯化铁
A.①②③ B.①④⑥ C.③⑤ D.①⑥
难度: 中等查看答案及解析
-
下列有关NaClO和NaCl混合溶液的叙述正确的是
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO不能大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生22.4LCl2,转移电子约为6.02×1023个
难度: 困难查看答案及解析
-
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是
①
②
③
④
甲
C
N2
S
Fe
丙
CO2
NO2
SO3
Fe(NO3)3
A.①② B.②③ C.①④ D.③④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.电解精炼铜时,若转移了NA个电子,则阳极质量减少32 g
B.1molSiO2中有2NA个硅氧键
C.1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目小于NA
D.1mol Cl2与过量的铁反应,转移3NA个电子
难度: 中等查看答案及解析
-
下列各组物质充分反应后过滤,将滤液加热、蒸干、灼烧至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的CO2
B.向带有氧化膜的铝片中加入盐酸
C.向含有1molCa(HCO3)2的溶液中加入1molNa2O2
D.向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2
难度: 困难查看答案及解析
-
某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是
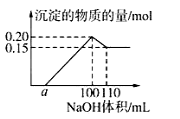
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
难度: 困难查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加BaC12溶液,再滴加盐酸
生成白色沉淀
原溶液中有SO42-
B
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+无K+
C
滴加氯水和CC14,振荡、静置
下层溶液显紫色
原溶液中有I-
D
滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+ = SO2↑+ H2O
B.向Na2SiO3溶液中通入过量SO2:SiO32-+SO2 +H2O = H2SiO3↓+SO32-
C.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D.向CuSO4溶液中加入Na2O2:2Na2O2 +2Cu2++2H2O=4 Na++2Cu(OH)2↓+O2↑
难度: 中等查看答案及解析
-
0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.66 D.69
难度: 中等查看答案及解析
-
事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2 +SO2 = Na2SO4 2Na2O2 +2SO3= 2Na2SO4 +O2据此,你认为下列反应方程式中正确的是
A.2Na2O2 + 2N2O4= 4NaNO3
B.Na2O2 + 2NO2 = 2NaNO2 + O2
C.2Na2O2 + 2N2O3= 4NaNO2 + O2
D.2Na2O2 + 2 Mn2O7 = 4Na2MnO4 + O2
难度: 中等查看答案及解析
-
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是
A.上述反应是放热反应
B.该反应氧化剂与还原剂物质的量之比为6∶5
C.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
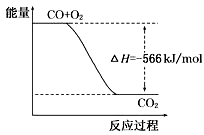
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH >-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
下列关于碱金属某些性质的排列中,正确的是
A.原子半径:Li<Na<K<Rb<Cs
B.密度:Li<Na<K<Rb<Cs
C.熔点、沸点:Li<Na<K<Rb<Cs
D.还原性:Li>Na>K>Rb>Cs
难度: 中等查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的体积相等时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶5 C.1∶9 D.2∶9
难度: 困难查看答案及解析
-
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A.四种元素中d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b.c.d与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
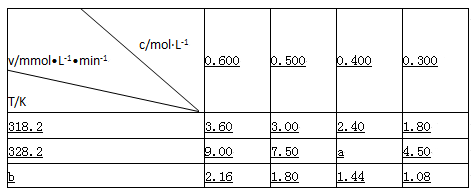
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
难度: 困难查看答案及解析