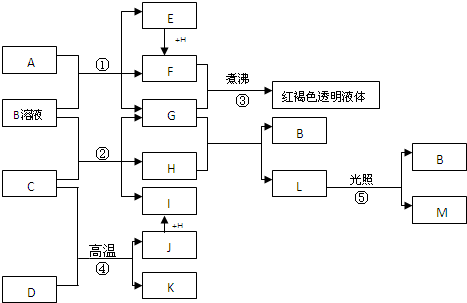
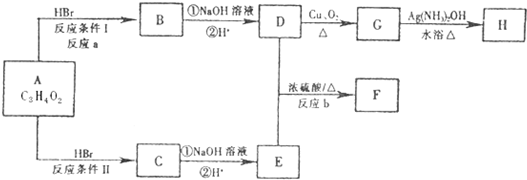
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3; ②还原性:Cl->As; ③每生成1molAs,反应中转移电子的物质的量为3mol; ④M为OH-;⑤SnCl62-是氧化产物.
A.①③⑤
B.①②④⑤
C.①②③④
D.只有①③难度: 中等查看答案及解析
-
在下列各说法中,正确的是( )
A.△H>0kJ•mol-1表示放热反应,△H<0kJ•mol-1表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热难度: 中等查看答案及解析
-
下列实验数据记录正确的是( )
A.用天平称取4.0克NaOH固体,用100mL量筒配制1.0000mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准碱液)滴定未知浓度的酸液22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500mL NO2气体,求得NO2气体的物质的量为0.5/22.4mol难度: 中等查看答案及解析
-
右图的一些物质或概念间的从属关系中不正确的是( )
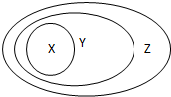
A.X氧化物:苯的同系物
Y化合物:芳香烃
Z纯净物:芳香族化合物
B.X氧化物:胶体
Y化合物:分散系
Z纯净物:混合物
C.X氧化物:电解质
Y化合物:离子化合物
Z纯净物:化合物
D.X氧化物:碱性氧化物
Y化合物:金属氧化物
Z纯净物:氧化物难度: 中等查看答案及解析
-
用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[c(H+)/c(OH一)].常温下,在AG=10的溶液中能大量共存的离子是( )
A.NH4+、Fe2+、I一、SO42-
B.Fe2+、K+、Cl-、NO3-
C.Na+、K+、ClO-、S2-
D.Na+、SO32-、AlO2-、K+难度: 中等查看答案及解析
-
为了使(NH4)2SO4溶液中c(NH4+)和c(SO42-)之比更接近2:1,可向溶液中加入少量( )
A.氢氧化钠溶液
B.硫酸
C.盐酸
D.硫酸钠溶液难度: 中等查看答案及解析
-
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等难度: 中等查看答案及解析
-
某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧原子的质量分数为50%,则分子中碳元素的质量分数的最大值约为( )
A.38.6%
B.42.8%
C.46.9%
D.无法计算难度: 中等查看答案及解析