-
将一小粒钠投入氯化铜溶液中,待反应停止后,观察到的现象是( )
A. 有蓝色沉淀 B. 有蓝色沉淀和气体产生
C. 有气体产生,无沉淀生成 D. 无沉淀和有气体产生
难度: 中等查看答案及解析
-
下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类变化的是( )
A. Na和O2 B. Ca(OH)2和CO2 C. Fe和HCl D. C和O2
难度: 困难查看答案及解析
-
下列物质充分反应后,滴加KSCN溶液显红色的是( )
A. FeO +盐酸 B. 铁+稀硫酸 C. FeCl2(溶液)+Cl2 D. Fe+CuSO4(溶液)
难度: 中等查看答案及解析
-
把一块生锈的铁片投入盛有稀硫酸的烧杯里,待铁片完全溶解后,往烧杯里滴加氢氧化钠溶液至过量,然后过滤,并充分灼烧不溶物,则最终留下的固体是( )
A. Na2O B. Fe2O3和Fe C. Fe2O3 D. Fe2O3和NaOH
难度: 中等查看答案及解析
-
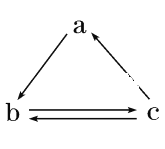
有关Na2CO3和NaHCO3的性质,下列叙述错误的是( )
A. 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象
难度: 困难查看答案及解析
-
已知有关物质的还原性强弱顺序是SO2>I->Fe2+>Br->Cl-,则以下反应能够发生的有( )
① I2+SO2+2H2O=H2SO4+2HI ② FeCl2+ C12=2FeCl3
③ FeC13+2HI=2FeCl2+2HCl+I2④ FeCl3+2HBr=2FeCl2+2HCl+ Br2
A. ①②③ B. ①③ C. ②④ D. ①②③④
难度: 中等查看答案及解析
-
在5NH4NO3═ 2HNO3+4N2↑+9H2O中,发生氧化反应的氮原子和发生还原反应的氮原子的质量比是
A. 1:1 B. 3:5 C. 5:3 D. 2:8
难度: 中等查看答案及解析
-
下列叙述中不正确的是
A. Na2O2是淡黄色固体,Na2O是白色固体,二者与水反应都能生成NaOH
B. CO2能和Na2O2发生反应生成O2,Na2O2既是氧化剂,又是还原剂
C. lmol H2充分燃烧后,产物被Na2O2完全吸收,Na2O2固体增重18g
D. 120℃时,0.5mol CO2和水蒸气的混合气体与足量Na2O2充分反应后,剩余气体质量为8g
难度: 中等查看答案及解析
-
下列物质反应后一定有+3价铁生成的是
① Fe(过量)在Cl2燃烧;② Fe与过量稀H2SO4反应;③ Fe(NO3)2溶液中加少量盐酸;④ FeO和Fe2O3的混合物溶于盐酸中
A. ① ② ④ B. ① ③ ④ C. ① ② ③ D. ② ③ ④
难度: 简单查看答案及解析
-
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为
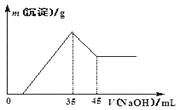
A. 1.75 mol·L-1
B. 3.50 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
难度: 中等查看答案及解析