-
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A. d元素的非金属性最强
B. 它们均存在两种或两种以上的氧化物
C. 只有a与其他元素生成的化合物都是离子化合物
D. b、c、d与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Y>Z
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物 D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 困难查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A. 氘(D)原子核外有1个电子
B. 1H与D互称同位素
C. H2O与D2O互称同素异形体
D. 1H218O与D216O的相对分子质量相同
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. Z、W均可与Mg形成离子化合物
D. 最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
A. 单质的沸点:W>X B. 阴离子的还原性:W>Z
C. 氧化物的水化物的酸性:Y<Z D. X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
不能用元素周期律解释的是
A. 酸性: H2SO4>H3PO4 B. 非金属性: Cl> Br
C. 碱性: NaOH> Mg(OH)2 D. 热稳定性: Na2CO3> NaHCO3
难度: 中等查看答案及解析
-
下列说法正确的是
A. I的原子半径大于Br,HI比HBr的热稳定性强
B. P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C. Al2O3和MgO均可与NaOH溶液反应
D. SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A. 原子最外层电子数由多到少的顺序:Y、X、W、Z
B. 原子半径由大到小的顺序:W、Z、Y、X
C. 元素非金属性由强到弱的顺序:Z、W、X
D. 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D. F-
难度: 中等查看答案及解析
-
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是
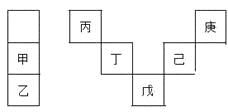
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
难度: 中等查看答案及解析
-
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 简单查看答案及解析