-
化学与社会、生产、生活密切相关。下列有关说法正确的是
A. 油脂、糖类和蛋白质都是天然高分子化合物
B. 天然纤维、聚酯纤维、光导纤维都属于有机高分子材料
C. 人工制造的分子筛是一种具有微孔结构的铝硅酸盐材料
D. 为消除碘缺乏病,我国政府规定在食盐中必须添加一定量的KI
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,7.0 g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
B. T ℃时,1 L pH=6的纯水中,含OH-的数目为10-8NA
C. 向1 L的密闭容器中充入46 g NO2气体,容器中气体的分子数为NA
D. 标准状况下,1 mol Na2O2与22.4 L SO2反应,转移电子数为NA
难度: 中等查看答案及解析
-
己知HNO2在低温下较稳定,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表,且酸性:H2SO3>HNO2>CH3COOH。下列有关说法错误的是
pH范围
>7
<7
产物
NO3-
NO、N2O、N2中的一种
A. 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-=NO3-+Cl-
B. 向冷的NaNO2溶液中通入H2S气体,有淡黄色沉淀产生
C. 向冷的NaNO2溶液中通入SO2可得到HNO2
D. 低温时不用其它试剂即可区分HNO2溶液与Na2CO3溶液
难度: 中等查看答案及解析
-
下列实验操作、现象和结论都正确的是
选项
实验操作
实验现象
实验目的
A
向待测液中滴加盐酸和稀硫酸
产生白色沉淀
待测液中含有Ag+
B
溴水中加入苯,充分振荡、静置
水层几乎为无色
苯与溴发生了化学反应
C
向稀硝酸与铜反应后的试管中(铜片剩余)加入稀硫酸
铜片完全溶解
稀硫酸可以将铜片氧化
D
滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
不能确定原溶液中是否含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
难度: 中等查看答案及解析
-
某有机物的结构简式为
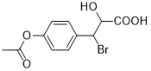 ,下列关于该有机物的说法正确的是
,下列关于该有机物的说法正确的是A. 该有机物的分子式为C11H12O5Br
B. 该有机物可以发生加成、取代、还原反应
C. 1 mol该有机物最多与3 mol NaOH 反应
D. 1 mol该有机物与足量的金属钠反应可产生22.4 L H2
难度: 中等查看答案及解析
-
我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。“吸入”CO2时,其工作原理如下图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法中错误的是

A. “吸入”CO2时,电流流向为:MWCNT→导线→钠箔
B. “呼出”CO2时,Na+向多壁碳纳米管电极移动
C. 放电时,正极的电极反应式为:3CO2+4Na++4e-=2Na2CO3+C
D. 电解液选用高氯酸钠-四甘醇二甲醚的优点是导电性好,与金属钠不反应,难挥发
难度: 中等查看答案及解析

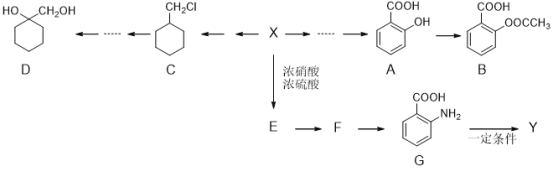
 ;
; (苯胺,易被氧化);
(苯胺,易被氧化);