-
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。 下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法正确的是( )
A. 二氧化硫可广泛用于各类食品的漂白
B. 从海水提取任何物质都必须通过化学反应才能实现
C. 用热的纯碱溶液清除油圬
D. “地沟油”禁止食用,也不能用来制肥皂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 各为0.1 mol的羟基(—OH)和OH-中含有的电子数目均为0.9NA
B. 标准状况下,22.4 L O2与44.8 L SO2充分反应后转移电子的数目为4NA
C. 标准状况下,11.2 L苯中所含的分子数为0.5NA
D. 1L 0.1 mol/L的NaClO溶液中含有的ClO-离子数目小于0.1NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 实验室用盐酸酸化高锰酸钾溶液
B. 铁制或铝制容器可以盛装热的浓硫酸
C. 常温下,所有吸热反应都不能自发进行
D. 除去MgCl2溶液中少量FeCl3杂质,可加入足量的MgO粉末搅拌后过滤
难度: 简单查看答案及解析
-
下列关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时,粗铜作阴极
C. 在镀件上电镀铜时可用金属铜做阳极
D. 电解稀硫酸制H2和O2时铜做阳极
难度: 中等查看答案及解析
-
一定温度下,在恒容的密闭容器中建立下列平衡:C(s) + H2O(g) ⇌ CO(g) + H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A. 混合气体的密度不再发生变化
B. v正(CO) = v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W原子的最外层电子数之和为16,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。下列说法正确的是
A. 单质的沸点:Y>Z
B. X、Y、Z三种元素不可能形成离子化合物
C. X的最高价氧化物对应的水化物的酸性比W的强
D. Y分别与Z、W形成的化合物中化学键类型相同
难度: 中等查看答案及解析
-
在一定温度时,将1 mol A和2 mol B放入容积为5 L 的某密闭容器中发生如下反应:A(s) + 2B(g) ⇌ C(g) + 2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol·L-1。下列叙述不正确的是( )
A. 5 min时容器内气体总的物质的量为3 mol
B. 5 min时,容器内D的浓度为0.2 mol·L-1
C. 该可逆反应随反应的进行,容器内压强逐渐增大
D. 在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
难度: 中等查看答案及解析
-
利用相关数据作出的推理或判断不正确的是( )
A. 利用键能大小的数据,可以估算化学反应的焓变
B. 利用原子半径的数据,可推断元素的主要化合价
C. 利用0.1mol/L的醋酸溶液pH数据,可推测醋酸是否为强酸
D. 利用不同温度时的平衡常数的数据,可推测某可逆反应是否为放热反应
难度: 中等查看答案及解析
-
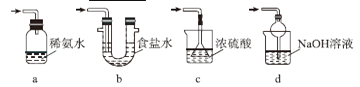
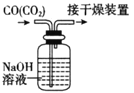
下列有关实验的选项正确的是
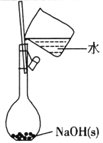
A.配制0. l0mol/L NaOH溶液
B.除去CO中的CO2
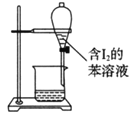
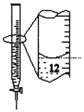
C.苯萃取碘水中的I2,分出水层后的操作
D.记录滴定终点读数为12.20 mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g) ⇌ N2O4(g),达到平衡后,慢慢压缩容器的体积,下列叙述正确的是( )
A. 若体积减小一半,则压强为原来的两倍
B. 平衡向正反应方向移动,混合气体颜色一定会变浅
C. 若体积减小一半,则压强增大,但小于原来的两倍
D. 平衡向正反应方向移动,混合气体的平均相对分子量减小
难度: 中等查看答案及解析
-
某温度下,0.1 mol·L-1 NaHA的强电解质溶液中,已知该溶液中c(H+) < c(OH-),则下列关系一定不正确的是( )
A. c(Na+) = c(HA-) + 2c(A2-) + c(OH-)
B. c(H2A) + c(HA-) + c(A2-) = 0.1 mol·L-1
C. 将上述溶液稀释至0.01 mol·L-1,c(H+)·c(OH-)不变
D. 溶液中存在:c(Na+) > c(HA-) > c(OH-) > c(H2A) > c(H+) > c(A2-)
难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法正确的是( )
A. Ksp(AB2) < Ksp(CD),则物质AB2的溶解度一定小于物质CD的溶解度
B. 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C. 在硫酸钡的沉淀溶解平衡体系中,加入饱和碳酸钠溶液,平衡不移动
D. 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
难度: 中等查看答案及解析
-
常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
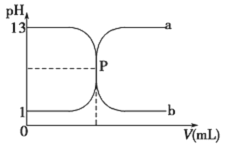
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1mol•L-1
D. P点时恰好完全中和,溶液呈中性
难度: 困难查看答案及解析
-
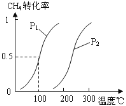
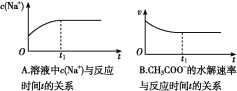
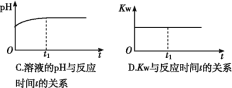
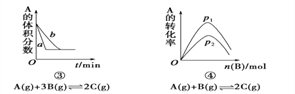
(题文)下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
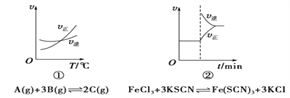
A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
难度: 困难查看答案及解析
-
在一定温度下,反应
H2(g)+
X2(g)⇌HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A. 5% B. 17% C. 25% D. 33%
难度: 中等查看答案及解析