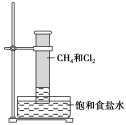
-
下列各组名词或现象中,三者间没有逐级因果关系的是
A. 汽车尾气——光化学污染——咳嗽和气喘者增多
B. 含磷洗衣粉——水体富营养化——水栖生物大量死亡
C. 人口增多——空气中CO2浓度增大——温室效应
D. 氟氯烃——臭氧空洞——皮肤癌患者增多
难度: 中等查看答案及解析
-
电解硫酸铜溶液要达到如下三个要求:①阳极质量减小,②阴极质量增加,③电解过程中Cu2+浓度不变。则可选用的电极是( )
A.石墨作阳极,铁作阴极
B.粗铜(含Fe、Ni、Zn)作阳极,纯铜作阴极
C.纯铜作阳极,铁作阴极
D.铁作阳极,纯铜作阴极
难度: 中等查看答案及解析
-
用石墨作电极,电解1 mol·L-1下列物质的溶液,则电解前后溶液的pH保持不变的是( )
A. H2SO4 B. NaOH C. Na2SO4 D. NaCl
难度: 中等查看答案及解析
-
2011年是国际化学年,我国举行了以“化学——我们的生活,我们的未来……”为主题的系列活动。下列说法中不正确的是( )
A. 使用“无磷洗涤剂”,促进水体富营养化
B. 研发易降解的塑料,防止白色污染
C. 回收处理工业废气,减少大气污染
D. 安装煤炭“固硫”装置,降低酸雨发生率
难度: 简单查看答案及解析
-
空气污染物通常以气态形式进入地面或低层大气环境。空气污染物与其主要来源不对应的是( )
污染物
来源
A
HCHO
家具生产与使用、质量低劣的涂料的使用
B
NO和NO2
飞机、汽车尾气
C
悬浮颗粒物
建筑施工、燃煤的使用
D
SO2
雷电时在空气中产生
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
苯乙烯是一种重要的有机化工原料,其结构简式为
,它一般不可能具有的性质是 ( )
A. 易溶于水,不易溶于有机溶剂
B. 在空气中燃烧产生黑烟
C. 它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D. 能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
难度: 中等查看答案及解析
-
下列说法不正确的是
A.淀粉、纤维素水解的最终产物均为葡萄糖
B.糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应
C.葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应
D.天然油脂没有固定的熔点和沸点,所以天然油脂是混合物
难度: 中等查看答案及解析
-
某有机物的结构如图所示,这种有机物不可能具有的性质是

①可以与氢气发生加成反应;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
A. ①④ B. 只有⑥ C. 只有⑤ D. ④⑥
难度: 中等查看答案及解析
-
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是

A. a为负极、b为正极 B. a为阳极、b为阴极
C. 电解过程中,d电极质量增加 D. 电解过程中,氯离子浓度不变
难度: 简单查看答案及解析
-
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和氯化钠溶液,通电时,为使
被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分的判断正确的是( )

A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
难度: 中等查看答案及解析
-
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A.
 B.
B. 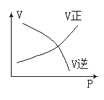
C.
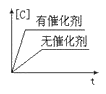 D.
D. 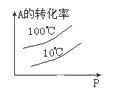
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)
C(g)+D(g)已达平衡的是
A. 混合气体的压强 B. 混合气体的密度
C. C、D的物质的量的比值 D. 气体的总物质的量
难度: 中等查看答案及解析
-
常温下,将pH=11 NaOH溶液和pH=3的乙酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是( )
A. c(CH3HCOO-)> c(Na+) B. c(CH3HCOO-)< c(Na+)
C. c(OH-)> c(CH3HCOO-) D. c(OH-)= c(CH3HCOO-)
难度: 中等查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,以下操作会导致测得的NaOH溶液浓度偏高的是( )
A. 滴定前滴定管有气泡,滴定后气泡消失
B. 碱式滴定管量取NaOH溶液时,未进行润洗操作
C. 滴定达到滴定终点时俯视读数
D. 锥形瓶在取用NaOH待测液前用少量水洗涤
难度: 中等查看答案及解析