-
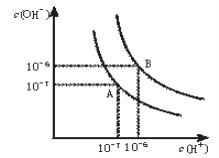
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A. c(R2-)+ c(OH-)=c(Na+)+c(H+) B. c(R2-)>c(Na+)>c(H+)=c(OH-)
C. 2c(R2-)+ c(HR-)=c(Na+) D. 混合后溶液的体积为2a L
难度: 中等查看答案及解析
-
将0.lmol·
醋酸溶液加水稀释,下列说法正确的是()
A. 溶液中c(H+)和c(OH-)都减小 B. 溶液中c(H+)增大
C. 醋酸电离平衡向左移动 D. 溶液的pH增大
难度: 简单查看答案及解析
-
下列溶液加热蒸干后,能析出溶质固体的是
A. AlCl3 B. KHCO3 C. Fe2(SO4)3 D. NH4HCO3
难度: 简单查看答案及解析
-
已知反应:①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH="-221" kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) ====H2O(l) ΔH="-57.3" kJ·mol-1
下列结论正确的是( )
A. 碳的燃烧热大于110.5 kJ·mol-1
B. ①的反应热为221 kJ·mol-1
C. 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 在纯水中,c(H+) = c(OH-) = 10-7 mol/L,呈中性
B. 常温下溶液中,若c(H+) > 10-7 mol/L,则c(H+) > c(OH-),呈酸性
C. c(H+)越大,则pH越大,溶液的碱性越强
D. pH为0的溶液,其中只有H+而无OH-
难度: 简单查看答案及解析
-
把a.b.c.d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a.b相连时,a为负极;c.d相连时,电流由d到c;a.c相连时,c极上产生大量气泡;b.d相连时,b上有大量气泡产生。则四种金属的活动性顺序由强到弱的为
A. a>b>c>d B. a>c>d>b
C. c>a>b>d D. b>d>c>a
难度: 简单查看答案及解析
-
可逆反应:2NO2
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
在新制的氯水中存在平衡:Cl2+H2O
H++Cl-+HClO 若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是
A. pH值增大,HClO浓度减小 B. pH值减小,HClO浓度增大
C. pH值增大,HClO浓度增大 D. pH值减小,HClO浓度减小
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B. 氢氧燃料电池的负极反应式:O2 +2H2O+ 4e-=4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g)
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: ① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
25 ℃时,下列四种溶液中由水电离生成的氢离子浓度之比(①∶②∶③)是
① pH = 0的盐酸 ② 0.1 mol/L的盐酸 ③ 0.01 mol/L的NaOH溶液
A. 1∶10∶100 B. 0∶1∶12
C. 14∶13∶12 D. 14∶13∶2
难度: 简单查看答案及解析
-
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2===K2CO3+3H2O,下列说法错误的是( )
A. 通甲烷的一极为负极,通氧气的一极为正极
B. 放电时,通入O2一极附近溶液的pH升高
C. 放电一段时间后,KOH的物质的量不发生变化
D. 通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O
难度: 困难查看答案及解析
-
用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为
A. 13 B. 12 C. 8 D. 1
难度: 简单查看答案及解析
-
pH=2的A、B两种一元酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示, 则下列说法正确的是
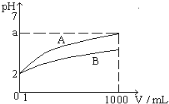
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a = 5时, A是弱酸, B是强酸
D. 若A、B都是弱酸, 则5 > a > 2
难度: 困难查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e- + OH-===NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 极难查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L该酸溶液的pH约为3
B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
难度: 中等查看答案及解析
-
如图:电流计的指针会偏转,M极变粗,N极变细符合这种现象的是

A. M是铜,N是锌,R是硫酸溶液
B. M是锌,N是铜,R是硫酸铜溶液
C. M是银,N是锌,R是硝酸银溶液
D. M是铁,N是铜,R是硝酸铜溶液
难度: 简单查看答案及解析
-
在1LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 0.5 mol·L-1
难度: 简单查看答案及解析