-
下列有关叙述正确的是( )
A. “一代材料,一代飞机”,据悉2017年国产大飞机C919中使用了素有“现代工业骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料
B. 离子交换膜在工业上应用广泛,如氯碱工业中使用阴离子交换膜
C. 获得2015年诺贝尔生理学、医学奖屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理
D. 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 18 g D2O和18 g H2O中含有的分子数均为NA
B. 2 L 0.5 mol/L亚硫酸溶液中含有的H+数目为2NA
C. 过氧化钠与水反应生成2.24 L氧气时,转移的电子数目为0.2NA
D. 室温下,46 g NO2与N2O4混合物中含有的氮原子数为NA
难度: 中等查看答案及解析
-
全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色)
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A. 充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B. 充电时,阳极附近溶液由绿色逐渐变为紫色
C. 放电时,负极反应为V2+-e-===V3+
D. 放电过程中,正极附近溶液的酸性减弱
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中
铜粉溶解,溶液变蓝
金属铁比铜活泼
C
将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液
溶液红色加深
增大反应物浓度,平衡正向移动
D
向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液
先有白色沉淀生成,后有黑色沉淀生成
相同温度下,Ag2S的溶度积比AgCl的小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“分子机器设计和合成”有着巨大的研究潜力。人类步入分子器件时代后,使得光控、温控和电控分子的能力更强,如图所示是蒽醌套索醚电控开关原理。
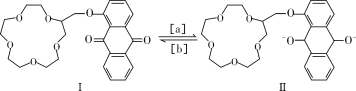
下列说法错误的是
A. 物质Ⅰ的分子式是C25H28O8
B. 1 mol物质Ⅰ可与8 mol H2发生加成反应
C. 反应[a]是氧化反应
D. 物质Ⅰ的所有原子不可能共平面
难度: 中等查看答案及解析
-
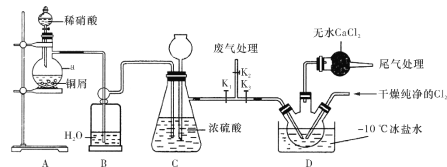
短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如下图所示装置以制备E3B2,装置①用于制备B单质。
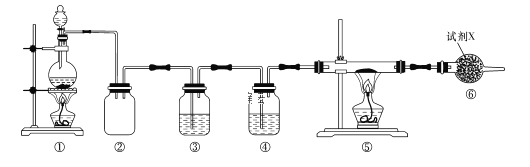
下列说法正确的是
A. E与B的简单离子的电子层结构相同,且简单离子半径B<E
B. ④⑥中依次盛装的试剂可以是NaOH溶液、碱石灰
C. D元素形成的单质与A2C不反应
D. 实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管口湿润的红色石蕊试纸变蓝的气体
难度: 中等查看答案及解析
-
常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是
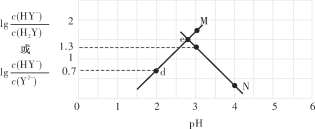
A. 曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系
B. Ka2(H2Y)=10-4.3
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
难度: 困难查看答案及解析