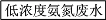-
在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
难度: 简单查看答案及解析
-
2.0molPC13和1.0molC12充入体积不变的密闭容器中,在一定条件下发生下述反应:PC13+C12⇌PC15 。达平衡时,PC15为0.40mol,如果此时移走1.0mol PC13和0.50mol C12,在相同温度下再达平衡时PC15的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
难度: 困难查看答案及解析
-
如图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
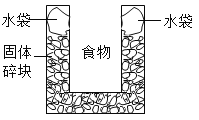
A. 硝酸铵 B. 氯化镁 C. 生石灰 D. 食盐
难度: 简单查看答案及解析
-
强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3KJ/mol
已知CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1KJ/mol
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH=-Q2KJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH=-Q3KJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
A. Q1=Q2=Q3 B. Q2>Q1>Q3 C. Q2>Q3>Q1 D. Q2=Q3>Q1
难度: 中等查看答案及解析
-
工业制氢气的一个重要反应是:CO(g)+H2O(g)⇌CO2(g)+H2(g),已知在25℃时:
C(石墨)+ 1/2O2(g)=CO(g) △H=-111kJ/mol
H2(g)+ 1/2O2(g)=H2O(g) △H=-242kJ/mol
C(石墨)+O2(g)=CO2(g) △H=-394kJ/mol
则25℃时,1molCO与水蒸气作用转化为氢气和二氧化碳反应的△H为( )
A. +41kJ/mol B. -41kJ/mol C. -283kJ/mol D. -131kJ/mol
难度: 中等查看答案及解析
-
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.
v(NH3)=v(O2) B.
v(O2)=v(H2O)
C.
v(NH3)=v(H2O) D.
v(O2)=v(NO)
难度: 简单查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
难度: 中等查看答案及解析
-
在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 困难查看答案及解析
-
对已经达到化学平衡的2X(g)+Y(g)
2Z(g)减小压强时,对反应的影响是( )
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
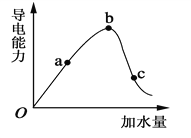
25 ℃时不断将水滴入0.1 mol/L的氨水中,下列图像变化合理的是( )
A.
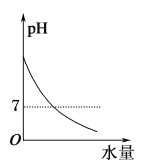 B.
B. 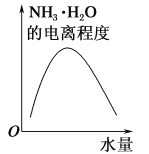 C.
C. 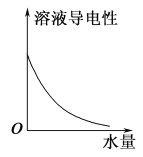 D.
D. 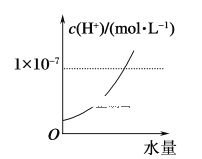
难度: 困难查看答案及解析
-
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-282.8kJ·mol-1
现有CO、H2、CO2组成的混合气体67.2L(标准状况),经完全燃烧后放出的总热量为710.0kJ,并生成18g液态水,则燃烧前混合气体中CO的体积分数为( )
A. 80% B. 50% C. 60% D. 20%
难度: 困难查看答案及解析
-
如图是用于通过测定单位时间内产生气体的体积来测量反应速率的装置,下列说法中正确的是( )
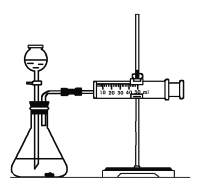
A. 如果在分液漏斗中加入稀硫酸,在锥形瓶中加入纯锌比加入粗锌产生氢气速率快
B. 如果在分液漏斗中加入浓硫酸,在锥形瓶中加入粗锌比加入纯锌产生氢气快
C. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸比加入稀硫酸和少量硫酸铜产生氢气速率快
D. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸和少量硫酸铜比加入稀硫酸产生氢气速率快
难度: 中等查看答案及解析
-
把下列四种X的溶液,分别加入盛有10mL 2mol·L-1盐酸的烧杯中,并均加水稀释到50mL,此时X和盐酸缓和地进行反应,其中反应速率最大的是
A.20mL 2mol·L-1 B.10mL 5mol·L-1
C.20mL 3mol·L-1 D.10mL 3mol·L-1
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 由H2、碘蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 加压可使更多的SO2转化为SO3
D. 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去。
难度: 困难查看答案及解析
-
可逆反应:A2(?)+B2(?) ⇌2AB(?),当温度和压强改变时,n(AB)的变化如下图,下列叙述正确的是
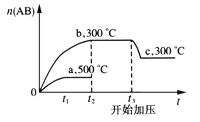
A. A2、B2及AB均为气体,ΔH<0
B. AB为气体,A2、B2至少有一种为非气体,ΔH<0
C. AB为气体,A2、B2有一种为非气体,ΔH>0
D. AB为固体,A2、B2有一种为非气体,ΔH>0
难度: 困难查看答案及解析