-
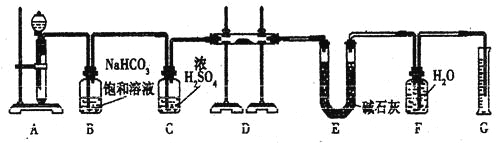
[2016全国Ⅰ]下列实验操作能达到实验目的的是
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A. 氧化镁用作耐火材料
B. 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 泡沫灭火器可用于一般的起火,也适用于电器起火
D. FeCl3溶液可用于刻蚀印刷铜电路板
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+的溶液中:Cu2+、Na+、Cl-、OH-
C. 在强酸性溶液中:K+、Fe2+、Cl-、CH3COO-
D. 在强碱溶液中:Na+、K+、Cl-、SO32-
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
A.BaCl2 、Na2CO3、盐酸 、AgNO3 B.BaCl2 、Na2CO3、、AgNO3 、盐酸
C.Na2CO3、 盐酸 、AgNO3、 BaCl2 D.AgNO3、盐酸、 BaCl2、Na2CO3
难度: 困难查看答案及解析
-
实验室配制一种仅含四种离子(不包括水电离的离子)的无色混合溶液,且要求混合溶液中四种离子的浓度均相等,下列选项能达到要求的是
A.Cu2+、NH4+、SO42-、NO3- B.Ca2+、Al3+、NO3-、Cl-
C.Na+、Mg2+、SO42-、I- D.H+、HCO3-、K+ 、F-
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A. 铁和稀硫酸反应:2Fe + 6H+ =2Fe 3++3H 2↑
B. NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O
C. 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
D. 氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2-+ 4NH4++ 2H2O
难度: 中等查看答案及解析
-
下列物质不能通过化合反应直接得到的是( )
A. CuS B. NaHCO3 C. FeCl2 D. Fe(OH)3
难度: 中等查看答案及解析
-
将NaCl、KAl(SO4)2、FeCl2、Fe2(SO4)3、Mg(NO3)2五种溶液,只用一种试剂通过实验就能加以区别,这种试剂是
A.KSCN B.BaCl2 C.NaCl D.NaOH
难度: 中等查看答案及解析
-
向HCl、NH4Cl、AlCl3溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)随加入NaOH溶液体积(V)的关系正确的是( )
A.
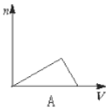 B.
B. 
C.
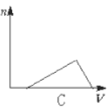 D.
D. 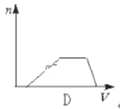
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,11.2 L SO3含有的分子数为0.5NA
B. 含有NA个原子的氦气体积约为22.4 L
C. 25 ℃、1.01×105 Pa时,44 g CO2中含有的氧原子数为2NA
D. 1 mol NaOH溶解在1 L水中,则其100 mL溶液中Na+数为0.1NA
难度: 简单查看答案及解析
-
配制100 mL 1.0 mol·L-1的NaOH溶液时,下列实验操作会使溶液浓度偏高的是( )
A. 称量时用滤纸盛放氢氧化钠固体
B. 转移溶液时,发现容量瓶中有水
C. 摇匀后,发现液面低于刻度,再补充几滴水至刻度
D. 在容量瓶中定容时俯视刻度线
难度: 中等查看答案及解析
-
某无色透明溶液中可能有Cu2+、Na+、CO32-、Ba2+、Cl—、SO42-,向其中加入适量盐酸有无色无味气体生成,再向其中加入硝酸银溶液有白色沉淀生成,则下列说法正确的是( )
A. 不可能存在的离子是:Cu2+、Ba2+、SO42-
B. 一定存在的离子是:Na+、CO32-
C. 可能存在的离子有:Na+、Cl—、SO42-
D. 无色气体为二氧化碳,沉淀为硫酸银
难度: 中等查看答案及解析
-
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿
a
b
c
d
Al.
A. b中铝元素是以阳离子形式存在
B. ①、②中除加试剂外,还需要进行过滤操作
C. ④进行的操作是加热,而且d一定是氧化铝
D. ③中需要通入过量的二氧化碳
难度: 中等查看答案及解析
-
两种金属粉末的混合物15 g,投入足量的稀盐酸中,得到5.6 L氢气(标准状况),则这种混合物可能是
A. 镁和铁 B. 镁和铝 C. 铁和锌 D. 铜和锌
难度: 中等查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
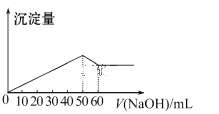
A. 1∶2 B. 3∶1
C. 2∶1 D. 6∶1
难度: 中等查看答案及解析
-
将铁和氧化铁的混合物2.72g加入50mL1.6mol/l的盐酸中,恰好完全反应,滴入KSCN溶液后不显红色,若忽略化学反应中溶液体积的变化,则在所得的溶液中,Fe2+的物质的量浓度为( )mol/l。
A. 0.2 B. 0.8 C. 0.4 D. 1.6
难度: 中等查看答案及解析