-
有些古文或谚语包含了丰富的化学知识,下列解释正确的是
A. “日照香炉生紫烟”是因为发生了碘的升华现象
B. “熬胆矾铁釜,久之亦化为铜”该过程发生了置换反应
C. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
D. “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化
难度: 中等查看答案及解析
-
设
为阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,
中含有极性共价键的数目为
B.
硫酸与足量铜反应,生成
的分子数为
C. 等体积、等物质的量浓度的
和
溶液中,阴、阳离子数目之和均约为
D.
晶体中阳离子和阴离子的总数为
难度: 简单查看答案及解析
-
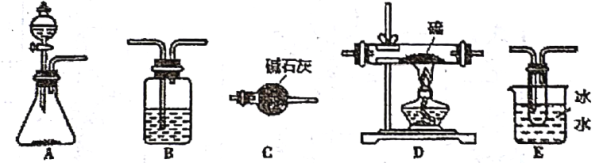
某学生利用以下装置探究喷泉实验.其中A、F分别为硫化氢和氯气的发生装置,C为纯净千燥的氯气与硫化氢反应的装置.打开
,将常温常压下的
控制等体积通入烧瓶且最终气体刚好充满烧瓶.

下列说法正确的是:
A. 装置A中的分液漏斗内液体a可选用稀硝酸
B. 虚线框B、D、E内从右上图的“备选装置”中选择合适装置的编号依次为Ⅲ、Ⅱ、Ⅰ
C. 立即看到烧瓶内产生“喷泉”现象
D. 本实验必须对烧瓶冷敷或热敷来引发喷泉
难度: 中等查看答案及解析
-
某溶液仅含
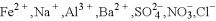 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是
A. 若向该溶液中加入过量的稀硫酸和
溶液,溶液显血红色
B. 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C. 该溶液中一定有
D. 若向该溶液中加入足量的
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
难度: 中等查看答案及解析
-
事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4 , 2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是
A. 2Na2O2+2N2O4═4NaNO3 B. Na2O2+2NO2═2NaNO2+O2
C. 2Na2O2+2N2O3═4NaNO2+O2 D. 2Na2O2+2 Mn2O7═4Na2MnO4+O2
难度: 中等查看答案及解析
-
下列各组物质按如图所示转化关系每一步都能一步实现的是

甲
乙
丙
丁
A
FeCl3
FeCl2
Fe2O3
Fe(OH)3
B
Cu
CuO
CuSO4
CuCl2
C
SO2
H2SO4
SO3
H2S
D
Al(OH)3
NaAlO2
Al2O3
AlCl3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
取
某物质放在盛有足量过氧化钠固体的容器中,然后通入足量
,用电火花不断引燃使其充分反应,最后称得固体的质量增加小于
,则该物质是
A. 甘油
B. 羟基乙酸
C. 乙醇
D. 蔗糖
难度: 简单查看答案及解析
-
已知很多气体都能用来做喷泉实验,若在同温同压下两个等体积烧瓶,一个收集满
和
的混合气体,另一个收集满
,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(
)和溶质的质量分数(
)关系是(两烧瓶所得溶液密度几乎相等)

A.
和
都不同 B.
和
都相同
C.
相同,
不同 D.
相同,
不同
难度: 中等查看答案及解析
-
向
含
和
的溶液中缓慢通入二氧化碳,随
(
)增大下列对应关系正确的是
选项
(
)/
溶液中离子的物质的量浓度
A
0
B
0.01

C
0.015

D
0.03
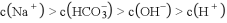
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
为周期表中前20号元素中的四种,原子序数依次增大,
为金属元素,
原子的最外层电子数是次外层电子数的3倍,
位于同周期,
单质是一种良好的半导体.
能与冷水剧烈反应,
原子的最外层电子数之和与
原子的最外层电子数之和相等.下列说法正确的是
A. 原子半径:
B. 气态氢化物的稳定性:
C. 最高价氧化物对应水化物的碱性:
D.
中共价键的数目为
难度: 中等查看答案及解析
-
下列叙述正确的是
A. H216O、D216O、H218O、D218O互为同素异形体
B. 电解熔融状态的
可以制得
,且都有氧气生成
C.
,水分子间的平均距离
:
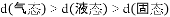
D. 海水中的
结晶成
的过程,形成了化学键
难度: 中等查看答案及解析
-
N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是

A. N2(g)+3H2(g)
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B. N2(g)+3H2(g)
2NH3(g) ΔH=2(b-a) kJ·mol-1
C. 1/2N2(g)+3/2H2(g)
NH3(l) ΔH=(b+c-a) kJ·mol-1
D. 1/2N2(g)+3/2H2(g)
NH3(g) ΔH=(a+b) kJ·mol-1
难度: 中等查看答案及解析
-
金属钛(
)抗腐蚀性能好,露置于空气中数年,仍光亮如初.以金红石(主要成分是
)为原料生产金属钦的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(
),得到
和一种可燃性气体;②在稀有气体环境和加热条件下,用
和
反应得到
和
,下列说法不正确的是
A. ①中的反应

B. ②中的稀有气体的作用是隔绝空气
C. ②中发生的反应为置换反应
D. 金属钛在常温下不与
反应
难度: 中等查看答案及解析
-
硼氢化钠(
)和
作原料的燃料电池,负极材料采用
,正极材料采用
,其工作原理如图.下列说法正确的是
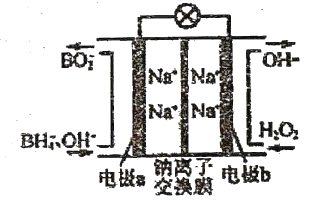
A. 电极
为正极,
为负极
B. 放电时,
从
极区移向
极区
C. 电极
上发生的电极反应为
D. 每生成
转移
电子
难度: 中等查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,并放出氢气,得到
的溶液,然后用
的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是

A. 原合金质量为
B. 产生氢气的体积为
(标准状况下)
C. 图中
的值为1.56
D. 图中
为100
难度: 中等查看答案及解析
-
已知氧化性
.现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用
的
溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
组别
①
②
③
④
50
50
50
50
混合粉末质量/
1.2
2.4
3.6
4.8
反应后剩余固体质量/
0
0.64
1.92
3.12
分析表中数据,下列结论不正确的是
A. 第①组反应后溶液中剩余
B. 第②、③组剩余固体全是铜
C. 第④组的滤液中
D. 原混合粉末中
难度: 中等查看答案及解析