-
等质量的CO和N2,下列叙述不正确的是( )
A. 密度一定相同 B. 分子数一定相同
C. 原子数一定相同 D. 物质的量一定相同
难度: 简单查看答案及解析
-
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入氢氧化钠溶液,开始时有白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,下列结论中正确的是 ( )
A. 一定有Fe2+,一定没有Fe3+、Mg2+
B. 一定有Fe3+,一定没有Fe2+、Mg2+
C. 一定有Fe3+,可能有Fe2+,一定没有Mg2+
D. 一定有Fe2+,可能有Mg2+,一定没有Fe3+
难度: 中等查看答案及解析
-
0.1 mol某元素的单质直接与足量氯气反应,质量增加7.1 g,这种元素可能是( )
A. 钠 B. 铝 C. 铁 D. 铜
难度: 简单查看答案及解析
-
“纳米技术”广泛应用于催化及军事科学中,“纳米材料”是粒子直径在1~100 nm(纳米)之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③是浊液 ④不能透过滤纸
⑤能透过滤纸 ⑥能产生丁达尔效应 ⑦静置后,会析出黑色沉淀
A. ②⑤⑥ B. ②⑥⑦ C. ①⑤ D. ③④⑦
难度: 中等查看答案及解析
-
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )
A. 乳浊液 B. 溶液 C. 胶体 D. 悬浊液
难度: 简单查看答案及解析
-
铝具有较强的抗腐蚀性能,主要是因为( )
A. 与氧气在常温下不反应 B. 铝性质不活泼
C. 铝表面能形成一层氧化膜 D. 铝耐酸耐碱
难度: 简单查看答案及解析
-
amol O2和amol O3相比较一定相同的是( )
A. 体积 B. 原子数 C. 分子数 D. 质量
难度: 简单查看答案及解析
-
下列物质中,与6 g CO(NH2)2(尿素)含氮物质的量不相同的是( )
A. 3.4 g氨气 B. 0.1 mol硝酸铵
C. 5.35 g氯化铵 D. 13.2 g硫酸铵
难度: 简单查看答案及解析
-
在同温、同压条件下,物质的量相同的氮气与氢气之间的关系不正确的是( )
A. 体积都是22.4 L B. 具有相同的体积
C. 具有相同的原子数 D. 具有相同的分子数目
难度: 简单查看答案及解析
-
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol•L﹣1,SO42—的物质的量浓度为0.7 mol•L﹣1,则此溶液中K+的物质的量浓度(mol•L﹣1)为( )
A. 0.1 B. 0.15 C. 0.2 D. 0.25
难度: 中等查看答案及解析
-
下列反应中关于“H2O”的说法错误的是( )
A. 2F2+2H2O=4HF+O2反应中,水作还原剂,失电子
B. 2Na+2H2O=2NaOH+H2↑反应中,水被氧化
C. CH4+2O2=CO2+2H2O反应中,H2O是还原产物
D. Na2O+H2O=2Na++2OH﹣反应中,水既不是氧化剂也不是还原剂
难度: 简单查看答案及解析
-
下图为蒸馏实验装置图,图中标示的四种仪器名称不正确的是( )
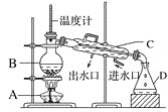
A. 酒精灯 B. 蒸馏烧瓶 C. 冷凝管 D. 烧瓶
难度: 简单查看答案及解析
-
下面做法或物质用途的叙述中错误的是( )
A. 盐卤可用于制豆腐 B. 活性炭作吸附剂
C. 以无水酒精作外科消毒剂 D. 明矾作净水剂
难度: 简单查看答案及解析
-
标准状况下,700 L氨气溶于1 L水得到密度为0.9 g·cm-3的饱和氨水,则该氨水的物质的量浓度约为( )
A. 16.4 mol·L-1 B. 17.4 mol·L-1 C. 18.4 mol·L-1 D. 19.4 mol·L-1
难度: 中等查看答案及解析
-
下列变化一定需要加入还原剂才能实现的是( )
A. HCO3—→CO2 B. HCl→Cl2
C. KClO3→KCl D. MnO4—→Mn2+
难度: 中等查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A. 氨气 B. 氯气 C. 硝酸铵 D. 硝酸
难度: 简单查看答案及解析
-
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
难度: 中等查看答案及解析
-
40.5 g某金属氯化物RCl2含有0.6 mol 氯离子,则金属R的摩尔质量为( )
A. 135 g B. 135 g·mol-1 C. 64 g D. 64 g·mol-1
难度: 中等查看答案及解析
-
在氢硫酸溶液中加入(或通入)少量下列物质: ①O2、②Cl2、③SO2、④CuCl2能使溶液中氢离子浓度增大的是( )
A. ①② B. ②③④ C. ②④ D. ②
难度: 简单查看答案及解析
-
将3.72 g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到672 mL混合气体。将该混合气体用电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比是( )
A. 3∶2∶1 B. 4∶2∶1 C. 2∶1∶1 D. 1∶1∶1
难度: 中等查看答案及解析
-
把ag铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为ag,则原合金中铁的质量分数为( )
A. 70% B. 52.4% C. 47.6% D. 30%
难度: 中等查看答案及解析
-
将一小块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有 ( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔化成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤ C. ②④⑤⑥ D. ③④⑥
难度: 中等查看答案及解析
-
下列检验Cl-的方法正确的是( )
A. 在某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-
B. 在某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
C. 在某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl
D. 在某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
难度: 简单查看答案及解析
-
下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是( )
A. 加热时无气体放出
B. 滴加盐酸时有气泡放出
C. 溶于水后滴加BaCl2稀溶液有白色沉淀生成
D. 溶于水后滴加澄清石灰水有白色沉淀生成
难度: 简单查看答案及解析
-
下列反应中说明氨气具有还原性和碱性的是( )
A. 2NH3+3CuO=3Cu+N2+3H2O
B. 8NH3+3Cl3=6NH4Cl+N2
C. 4NH3+6NO
5N2+6H2O
D. NH3+HCl=NH4Cl
难度: 简单查看答案及解析
-
焰色反应可用来检验( )
A. 所有元素的存在 B. 所有金属单质的存在
C. 某些金属单质或金属离子的存在 D. 所有非金属元素的存在
难度: 简单查看答案及解析
-
取氯化钠进行焰色反应实验,火焰呈现黄色,显色的原因是( )
A. 氯化钠受热挥发 B. 氯化钠受热分解
C. 钠离子中电子跃迁 D. 氯离子中电子跃迁
难度: 简单查看答案及解析
-
下列离子的检验方法合理的是( )
A. 向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+
B. 向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+
C. 向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+
D. 向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
难度: 中等查看答案及解析
-
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
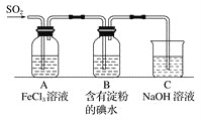
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
难度: 中等查看答案及解析
-
等质量的镁条分别在①氧气中、②空气中、③氮气中、④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是( )
A. ②<①<③<④ B. ④=①=②=③
C. ③<②<①<④ D. ③<①<②<④
难度: 中等查看答案及解析