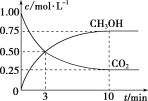
-
将下列气体通入溶有足量 SO2 的 BaCl2 溶液中,没有沉淀产生的是
A. NH3 B. HCl C. Cl2 D. NO2
难度: 困难查看答案及解析
-
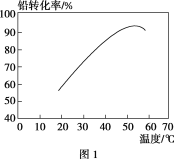
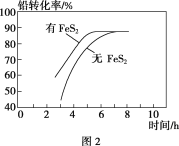
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A. M B. M2+ C. M3+ D. MO2+
难度: 中等查看答案及解析
-
《本草经集注》中记载了区别硝石(KNO3)和芒硝(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,这是运用了硝石的
A. 焰色反应 B. 氧化性 C. 还原性 D. 不稳定性
难度: 简单查看答案及解析
-
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是
A. 改进汽车尾气净化技术,减少大气污染物的排放
B. 开发利用可再生能源,减少化石燃料的使用
C. 研发可降解高分子材料,减少“白色污染”
D. 过度开采矿物资源,促进地方经济发展
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,1mol P4中所含P—P键数目为4NA
B. 100 mL 1 mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
D. 常温常压下,18g H2O含有的原子总数为3NA
难度: 中等查看答案及解析
-
X、Y、Z、M、W为原子序数依次增大的5种短周期主族元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味)。X、Y、Z三种元素形成化合物乙。下列说法不正确的是
A. 气体甲可与Z的某种氢化物反应生成强酸
B. W元素的晶体单质是一种良好的半导体材料
C. 化合物乙中一定只有共价键
D. X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM
难度: 中等查看答案及解析
-
室温时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液中:Ba2+、K+、CO32-、NO3-
B. 0.1 mol·L-1NaHCO3溶液中:K+、NO3-、Cl-、SO42-
C. 0.1 mol·L-1FeCl3溶液中:Al3+、Cu2+、Br-、I-
D. 由水电离产生的c(H+)=1×10-13 mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A.
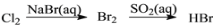
B.

C.

D.
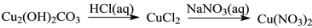
难度: 中等查看答案及解析
-
下列有关离子的检验方法、现象和结论都正确的是
选项
检验方法
现象
结论
A
向某溶液中滴加酸性KMnO4溶液
溶液紫色变浅
原溶液中一定含有 Fe2+
B
向某溶液中加入烧碱溶液,共热,用镊子夹一块湿润的红色石蕊试纸放在试管口正上方
试纸由红色变为蓝色
原溶液中一定含有 NH4+
C
向溴水中滴加某溶液
混合溶液由橙色变为无色
某溶液中一定含有SO32-
D
向某溶液中通入足量 CO2
产生白色沉淀
原溶液中一定含有AlO2-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 用过量石灰乳吸收工业尾气中的SO2: Ca2++2OH-+SO2=CaSO3 ↓+ H2O
B. 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C. 用铜做电极电解NaCl溶液:2C1—+2H2O
H2↑+Cl2↑+2OH-
D. 将 Fe2O3加入到 HI 溶液中:Fe2O3+ 6H+=2Fe3+ +3H2O
难度: 困难查看答案及解析
-
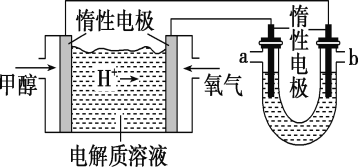
乙烷燃料电池的工作原理示意图如下,下列说法中正确的是
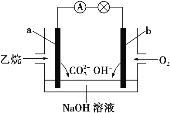
A. a 为负极,电极反应式为 CH3CH3-14e-+18OH-===2CO32-+12H2O
B. 电子从 a 极经导线移向 b 极,再经溶液移向 a 极
C. 电池工作一段时间后电解质溶液的 pH 增大
D. 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为 2∶1
难度: 中等查看答案及解析
-
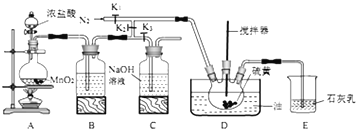
下列有关实验装置的说法正确的是
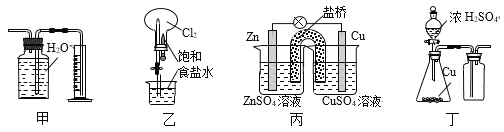
A. 用图甲装置收集并测量NO2的体积 B. 用图乙装置可以完成“喷泉”实验
C. 用图丙装置可以实现化学能转化为电能 D. 用图丁装置制取并收集SO2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
B. 已知2CO(g)+O2(g)==2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C. 已知H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3) kJ·mol-1
D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b
B. 混合溶液的PH=7
C. 混合溶液中,c(H+)=
mol.L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
难度: 中等查看答案及解析