-
化学与人类生产、生活密切相关,下列说法正确的是( )
A. 人体缺乏碘元素,可服用BaI2补充碘元素,且多多益善
B. 煤炭的化学成分是碳单质
C. 明矾常用作净水剂,分子式为K2SO4·Al(SO4)·12H2O
D. 放置过久的水含有较多的亚硝酸盐,对人体有害
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
A. 78克Na2O2和120克NaHSO4中所含阴离子数均为NA
B. 常温常压下,1mol氯气与足量NaOH反应完全生成NaClO、NaCl,转移电子数目为NA
C. 标准状况下,22.4L丁烷含有的非极性键数目为3NA
D. 常温下0.1L 0.1mol/LNH4NO3溶液中氮原子数目小于0.01NA
难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A. 用Fe电极电解NaCl溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B. 四氧化三铁溶于氢碘酸:Fe3O4+8H+ +2I-=3Fe2+ +4H20+I2
C. 碳酸氢钠溶液中加入足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O
D. 硫酸氢钠溶液与氢氧化钡溶液混合显中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
在水溶液中能大量共存的一组离子是( )
A. Fe3+、Na+、Cl-、SiO32- B. K+、Ba2+、ClO-、S2-
C. K+、Na+、S2-、SO32- D. H+、K+、SO32-、Br-
难度: 中等查看答案及解析
-
下列有关实验操作或结论正确的是( )
A. 在氢氧化铁胶体中逐滴加入稀硫酸,先有沉淀生成,后沉淀不消失
B. 配制新制的氢氧化铜浊液的方法是向2mL10%的氢氧化钠溶液中滴入4到6滴2%硫酸铜溶液
C. 用10mL量筒量取7.36mL 1mol/L氢氧化钠溶液
D. 实验室能用启普发生器制取的气体常见的有C2H2、CO2、H2S、H2、O2
难度: 中等查看答案及解析
-
已知:3BrF3 + 5H2O = O2 + HBrO3 + 9HF + Br2,下列说法正确的是( )
A. 水是还原剂,O2是还原产物
B. HF既是氧化产物又是还原产物
C. 当有5molH2O参加反应时,被水还原的BrF3的物质的量为4/3 mol
D. 当有2molH2O被氧化时,反应中转移了4mol e-
难度: 困难查看答案及解析
-
将SO2气体通入下列溶液中,始终不变浑浊的是( )
①氯化钙 ②硝酸钡 ③硅酸钠 ④偏铝酸钠 ⑤苯酚钠 ⑥硫化钠 ⑦氢氧化钙
A. ①②⑦ B. ①⑥ C. ① D. ①⑥⑦
难度: 中等查看答案及解析
-
在500mLFeBr2溶液中导入22.4L(在标准状况下)Cl2,充分反应后,溶液中1/3的Br-被氧化,则原溶液中FeBr2的物质的量浓度( )
A. 2.4mol/L B. 1.2mol/L C. 2.0mol/L D. 3.2mol/L
难度: 中等查看答案及解析
-
二氧化锰是常用的催化剂、氧化剂和活性电极材料.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2,1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
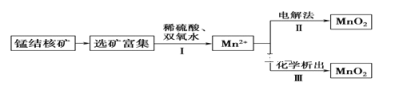
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )
A. 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑
B. 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+
C. 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+
D. 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+
难度: 简单查看答案及解析
-
某溶液中可能含有Na+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、CO32-、S2-、SO32-、AlO2-、Cl-、SO42-中的一种或几种,对该溶液进行实验,结果如图:
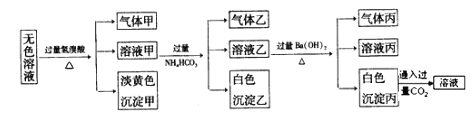
下列说法不正确的是( )
A. 淡黄色沉淀甲为AgBr,沉淀乙为Al(OH)3
B. 溶液中一定含有Na+、S2-、SO32-、AlO2-
C. 气体甲的成分可能是CO2或SO2或H2S或CO2、SO2的混合气体或CO2、H2S的混合气体
D. 确定溶液A中是否含有SO42-,可在沉淀丙中加入足量稀盐酸,若沉淀部分溶解则溶液A中含有SO42-,若沉淀全部溶解则溶液A中不含SO42-
难度: 困难查看答案及解析
-
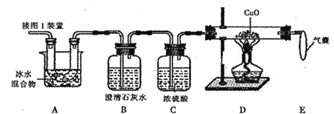
下列有关实验装置进行的相应实验,能达到实验目的是( )
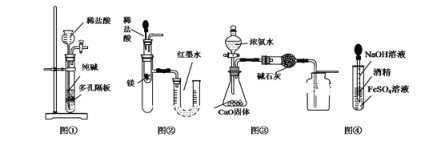
A. 用图①所示装置制取少量纯净的CO2气体
B. 用图②所示装置验证镁和盐酸反应的热效应
C. 用图③所示装置制取并收集干燥纯净的NH3
D. 用图④装置制备Fe(OH)2并能保证较长时间观察到白色
难度: 中等查看答案及解析
-
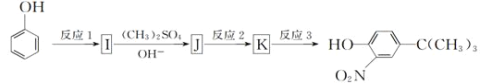
短周期元素W、X、Y、Z的原子序数依次增大,W元素的一种核素中无中子,X元素原子 的最外层电子数是内层电子数的3倍,且X、Y的简单离子的核外排布电子相同,X,Y,Z的核电荷数之和为36,工业上用海水生产Z的单质,同时生成含元素Y的碱。下列说法正确的是( )
A. 上述四种元素的原子半径大小为Y>X>Z>W
B. Y与Z形成的化合物中,Z、Y原子个数可能为1:2
C. 四种元素均能形成双原子单质分子
D. 四种元素两两形成的化合物分子中有4种离子化合物
难度: 中等查看答案及解析
-
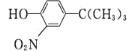
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
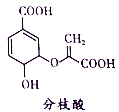
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
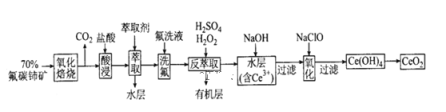
空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是( )
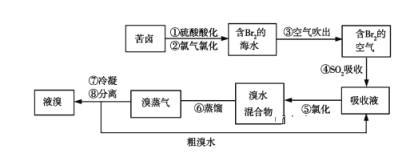
A. 步骤④⑤是为了富集溴
B. 步骤③说明溴具有挥发性
C. 步骤④的离子方程式为Br2+SO2+H2O=2H++2Br-+SO32-
D. 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离
难度: 困难查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60mL B. 90mL C. 120mL D. 45mL
难度: 困难查看答案及解析
-
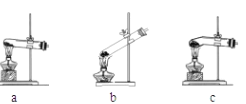
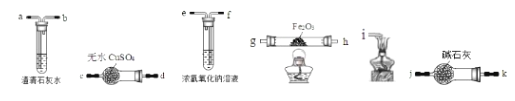
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
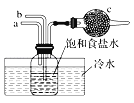
A. 先a通入CO2,然后b通入NH3,c中放碱石灰
B. 先b通入NH3,然后a通入CO2,c中放碱石灰
C. 先a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. 先b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析

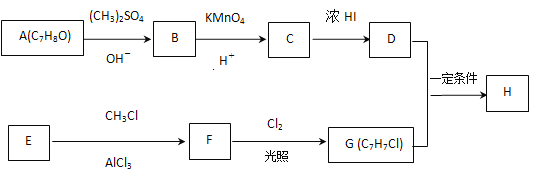
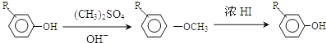 ;
;