-
(题文)“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中不正确的是( )
A.
B.
C.
D.




用灼烧法可鉴别毛笔羊毫的真伪
用墨写字画画可长久不褪色
纸及造纸原料的主要成分均是纤维素
用石材制作砚台的过程是化学变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列有关说法正确的是 ( )
A. 标准状况下,6.72 L NO2 与水反应转移的电子数为 0.1NA
B. 1 mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3NA
C. 1 mol Cl2 与足量 Fe 反应转移电子数一定为 3NA
D. 1 L 0.1 mol/L 的碳酸钠溶液中的阴离子总数等于 0.1NA
难度: 中等查看答案及解析
-
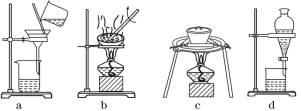
下列说法正确的是( )
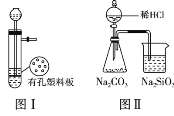
A. 图Ⅰ所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体
B. 图Ⅱ装置可验证非金属性:Cl>C>Si
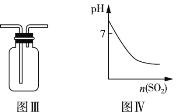
C. 图Ⅲ可用于收集气体 H2、CO2、Cl2、NH3
D. 图Ⅳ表示将 SO2 气体通入 H2S 水溶液中,所得溶液的 pH 变化
难度: 中等查看答案及解析
-
下列各组离子可能大量共存的是( )
A. 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32-
B. 常温下Kw/c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+
C. 常温下水电离出的c(H+)=10-10mol·L-1的溶液中Na+、K+、Cl-、HCO3-
D. 0.5 mol·L-1AlCl3溶液中:AlO2-、K+、CO32-
难度: 中等查看答案及解析
-
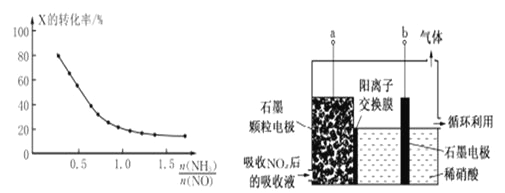
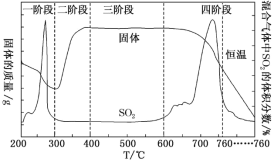
短周期元索M、N、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系。甲、丁为二元化合物(两种元素形成的化合物),乙、戊为单质,丙、己为三元化合物。已知25℃时,0.1mol/L的甲、丙两溶液的pH分别为l、13 ,丁、己两溶液混合时产生白色沉淀。下列推断正确的是
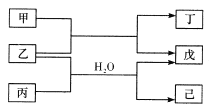
A. M分别与N、X、Z形成的简单化合物中,M与N形成的化合物熔点最高
B. 原子半径:Z>Y>X>M>N
C. X、Y、Z的最高价氧化物对应的水化物能相互反应
D. Z的阴离子结合质子的能力比N的阴离子强
难度: 困难查看答案及解析
-
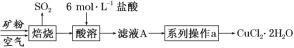
二氧化硫—空气质子交换膜燃料电池将化学能转变成 电能的同时,实现了制硫酸、发电、环保三位一体的结 合,降低了成本提高了效益,其原理如图所示。下列说 法错误的是( )
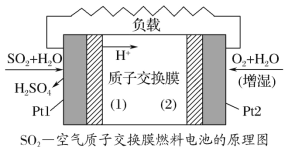
A. 该电池放电时电子从 Pt1 电极经过外电路流到 Pt2电极
B. Pt1 电极附近发生的反应为:SO2+2H2O-2e-===SO42-+4H+
C. 相同条件下,放电过程中消耗的 SO2 和 O2 的体积比为 2∶1
D. Pt2 电极附近发生的反应为 O2+4e-===2O2-
难度: 简单查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质
编号
物质转
化关系
a
b
c
d
①
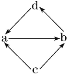
FeCl2
FeCl3
Fe
CuCl2
②
NO
NO2
N2
HNO3
③
Na2O
Na2O2
Na
NaOH
④
Al2O3
Na[Al(OH)4]
Al
Al(OH)3
A. ①④ B. ①②③ C. ①③④ D. ②④
难度: 中等查看答案及解析