-
下列有关硅及其化合物的说法正确的是 ( )
A. 晶体硅具有金属光泽,可以导电,属于金属材料
B. 常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C. SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D. 除去SiO2中混有的CaCO3可加入适量的稀盐酸
难度: 简单查看答案及解析
-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A. 烧碱溶液 B. 醋酸 C. 硝酸 D. 氢氟酸
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关NA的叙述中,正确的是 ( )
A. 1 mol NaHCO3晶体中所含的离子总数为3NA
B. 常温下,46gNO2与N2O4混合气体中所含的N原子数为NA
C. 标准状况下,22.4L水中所含的H2O分子数为NA
D. 在钠与过量氧气的反应中,1 mol 钠失去电子的数目为2NA
难度: 简单查看答案及解析
-
“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有下列性质中的( )
A. 能全部通过半透膜 B. 能全部通过滤纸
C. 粒子做布朗运动 D. 能发生丁达尔效应
难度: 简单查看答案及解析
-
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是( )
A. 在该反应中维生素C作氧化剂
B. 由上述信息可推知砒霜中含有的砷是+3价
C. 因为河虾中含有砷元素,所以不能食用
D. 上述反应中河虾中的+5价砷被氧化
难度: 简单查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
选项
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
分离乙醇和水
用分液漏斗分液
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
制备Fe(OH)2
直接往 FeSO4溶液中滴加NaOH溶液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
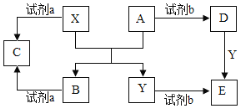
某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
A.
 Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完B.
 Ⅱ图:溶液变红证明新制氯水具有强氧化性
Ⅱ图:溶液变红证明新制氯水具有强氧化性C.
 Ⅲ图:瓶口有白雾生成
Ⅲ图:瓶口有白雾生成D.
 Ⅳ图:湿润的有色布条褪色
Ⅳ图:湿润的有色布条褪色难度: 简单查看答案及解析
-
类推的思维方法在化学学习与研宄中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否。下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;高温下铁与水反应也生成碱和H2
②氢氧化铝加热分解为金属氧化物和水;氢氧化镁、氢氧化铁也能加热分解生成相应的金属氧化物和水
③碳酸钠、碳酸氢钠溶液均显碱性;钠盐溶液均能使酚酞变红
④铝和硫反应生成Al2S3;铁与硫反应生成Fe2S3
A. ③④ B. ①③④ C. ②④ D. ①②③
难度: 中等查看答案及解析
-
下列离子在对应的溶液中能大量共存的是( )
A. 在强酸性溶液中: CH3COO-、 NO3-、Fe2+、 Na+
B. 在能使酚酞试液变深红色的溶液中:Ca2+、 Ba2+、 NO3-、HCO3-
C. 在含有Cl-、 Ba2+的溶液中:Na+、K+、HCO3-、NO3-
D. 在无色透明溶液中:Ba2+、Fe3+、Mg2+、 Cl-、NO3-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. 铜与稀硝酸反应:Cu+NO3-+4H+=Cu2++2NO2↑+2H2O
C. 实验室制备氢氧化铝:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 向氯化铁溶液中加入过量铁粉:Fe3++Fe=2Fe2+
难度: 中等查看答案及解析
-
有Na、Mg、Al、Fe、Cu五种金属,若两两混合,取混合物15g与足量稀硫酸反应后完全溶解,产生标准状况下H2 11.2L,求此混合物的组合方式最多有( )
A. 2种 B. 3种 C. 4种 D. 6种
难度: 中等查看答案及解析
-
在下列曲线中,纵坐标表示生成Al(OH)3的质量,横坐标表示加入试剂的体积。下列叙述中不正确的是( )
A.
图①可表示向NH3·H2O中滴加AlCl3溶液至过量
B.
图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
C.
 图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量D.
图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
难度: 中等查看答案及解析
-
2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞。据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。下列有关说法不正确的是
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,一定有氢氧化铜沉淀,也可能有铜析出
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
难度: 中等查看答案及解析
-
某混合气体可能含有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),则可断定该混合气一定有
A. HCl、CO2、H2 B. CO、H2、H2O C. CO、H2、NH3 D. HCl、CO、H2O
难度: 中等查看答案及解析
-
1L稀硝酸和稀硫酸的混合液,物质的量浓度分别为0.2mol/L和0.5mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 4.8g B. 19.2g C. 32.0g D. 36.8g
难度: 中等查看答案及解析
-
NO和CO2的混合气体,通过过量的Na2O2后,剩余气体体积为原来的一半,则NO和CO2的体积比为(不考虑NOx与Na2O2的反应及2NO2
N2O4)( )
A. 2:1 B. 1:2 C. 1:4 D. ≤1:1的任意比
难度: 中等查看答案及解析