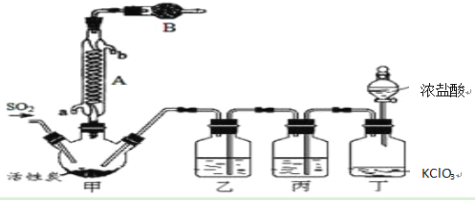
-
化学与生活息息相关。下列说法中错误的是
A. 铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物,防止餐具被腐蚀
B. 人工合成的硅橡胶是目前最好的既耐高温又耐低温的橡胶,常用于门窗密封
C. 铁制的容器在常温下可用来存放浓硫酸或浓硝酸是因为铁不与浓硫酸或浓硝酸反应
D. 去除锅炉上的水垢,通常先用碳酸钠溶液处理,形成疏松物质而后再用酸去除
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
B. 将1mol Cl2通入足量水中,溶液中HClO、Cl-、C1O-粒子数之和为2NA
C. .1L0.3mol/LNa2CO3溶液中的阴离子数目小于0.3NA
D. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
难度: 中等查看答案及解析
-
W、X、Y、Z是四种原子序数递增的短周期主族元素,W和X形成的化合物是汽车尾气成分之一,X和Z是同族元素且两者形成的某种化合物能使品红溶液褪色,常温下,Y的块状单质能溶于W或Z的最高价氧化物对应水化物的稀溶液,却不能溶于其冷的浓溶液,下列说法中正确的是
A. W的简单氢化物稳定性比X的简单氢化物稳定性强
B. 自然界中都存在W、X、Z元素对应的单质
C. X的简单氢化物沸点比Z简单氢化物低
D. 工业上制备单质Y,常通过电解其熔融状态的氯化物
难度: 简单查看答案及解析
-
下列实验操作、现象及结论都正确的是
选项
实验操作
现象
结论
A
同温下用广泛pH试纸测定等浓度的碳酸钠溶液和硅酸钠溶液的pH
滴有硅酸钠溶液的试纸蓝色更深
非金属性:C>Si
B
两支玻璃棒分别蘸取浓硫酸和浓氨水后靠近但不接触
玻璃棒之间产生白烟
浓硫酸和浓氨水发生反应生成白色固体
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置
上层液体呈紫色
氧化性:Br2>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是
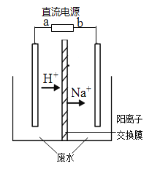
A. 直流电源a端连接的电极发生氧化反应
B. 若以氢氧燃料电池为直流电源,燃料电池的a极应通入H2
C. 反应进行一段时间,右侧电极附近酸性减弱
D. 电解过程中阳极区生成乙酸,阴极区生成乙醇
难度: 中等查看答案及解析
-
25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法正确的是( )
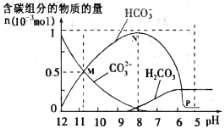
A. 0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+c(CO32—)+c(HCO3—)
B. 当加入10mL盐酸时,所得混合溶液pH>7
C. 当pH=8时,c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
D. 在M点:c(CO32—)=c(HCO3—)>c(Na+)>c(OH—)>c(H+)
难度: 中等查看答案及解析
-
取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法不正确的是
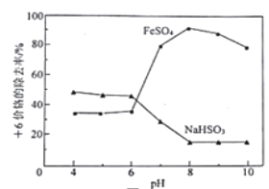
A. 当+6价铬足量且pH大于7时,等质量的FeSO4的除铬量比NaHSO3高
B. 若选用NaHSO3处理含铬污水时,不能将污水的酸性调节的过强
C. pH >8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 选择FeSO4做处理剂更有利于Cr(OH)3的沉降及分离
难度: 困难查看答案及解析
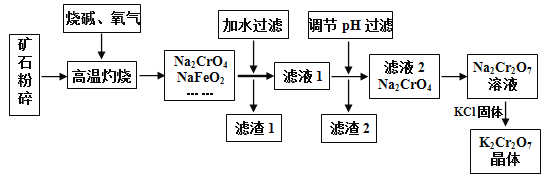
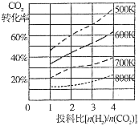
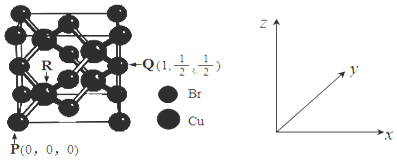
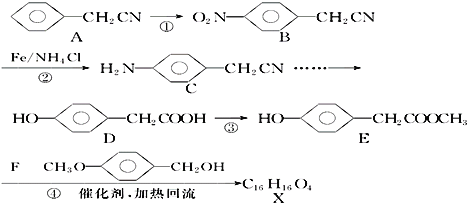
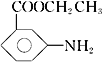 的合成路线图(无机试剂任用)____________。
的合成路线图(无机试剂任用)____________。