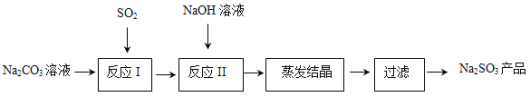
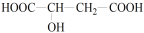-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是
A. 原子最外层电子数由多到少的顺序:Y、X、W、Z
B. 原子半径由大到小的顺序:W、Z、Y、X
C. 元素非金属性由强到弱的顺序:Z、W、X
D. 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
难度: 中等查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:
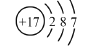
C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C-CH2Cl
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 正丁烷和异丁烷属于同系物
B. 分子式为 C2H6O的有机化合物性质相同
C. 碳元素的单质只存在金刚石和石墨这两种同素异形体
D. 有机化合物CH3—CH2—NO2和H2N—CH2—COOH是同分异构体
难度: 中等查看答案及解析
-
下列顺序表达正确的是
A. 酸性强弱:H3PO4 > HNO3 > HClO4 B. 原子半径:Na > Mg > O
C. 热稳定性:H2O > HF > H2S D. 熔点高低:NaCl > SiO2 > CO2
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是
A. 原子晶体中,共价键越强,熔点越高
B. 冰熔化时,水分子中共价键发生断裂
C. 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子晶体
D. 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.
和
是同分异构体
B. 甲烷、乙烯和苯在工业上都可通过石油分馏得到
C. 乙烯和氯乙烯都能发生加聚反应得到高分子材料
D. 甲醛的水溶液常用于种子杀菌消毒,可以用于浸泡食品
难度: 中等查看答案及解析
-
下列过程一定吸收热量的是
A. 化学反应过程中形成新的化学键 B. 干冰升华
C. 加热才能发生的化学反应 D. 氧化钙与水反应
难度: 简单查看答案及解析
-
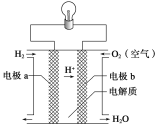
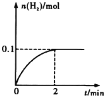
下图为合成氨反应(N2+ 3H2
2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是
A. 温度(T/K) B. 压强(P/Pa)
C. 反应时间(t/min) D. 氮气浓度(c/mol·L―1)
难度: 中等查看答案及解析
-
只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是
A. 碘水 B. 氢氧化铜悬浊液 C. 氢氧化钠溶液 D. 碳酸钠溶液
难度: 中等查看答案及解析
-
苯甲酸(C6H5COOH)和山梨酸(CH3CH=CHCH=CHCOOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是
A. 金属钠 B. 氢氧化钠 C. 溴水 D. 乙醇
难度: 中等查看答案及解析
-
为了除去括号内的杂质,其试剂选择和分离方法都正确的是
序号
物质(杂质)
所用试剂
分离方法
A
乙酸(乙醇)
氢氧化钠溶液
分液
B
乙烯(二氧化硫)
酸性高锰酸钾溶液
洗气
C
溴苯(溴)
碘化钾溶液
分液
D
乙醇(水)
生石灰
蒸馏
A. A B. B C. C D. D
难度: 中等查看答案及解析