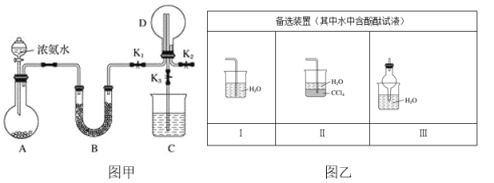
-
在无土栽培中,需配制一定量含50 mol NH4Cl,16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A. 2 ,64 ,24 B. 64 ,2 ,24 C. 32 ,50 ,12 D. 16 ,50 ,24
难度: 简单查看答案及解析
-
等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是
A. 第一块钠失去电子多 B. 两块钠失去电子一样多
C. 第二块钠的反应产物质量大 D. 两块钠的反应产物质量一样大
难度: 中等查看答案及解析
-
用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是
①二氧化碳 ②氯化氢 ③水蒸气 ④氧气
A. ①②③ B. ②③④ C. ②③ D. ①④
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在,丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
A. 甲乙丙丁 B. 丁乙丙甲 C. 丙乙丁甲 D. 乙丁丙甲
难度: 中等查看答案及解析
-
现有100 mL 3 mol·L-1氢氧化钠溶液和 100 mL 1 mol·L-1氯化铝溶液,若进行以下两种操作:①将氢氧化钠溶液分多次加入氯化铝溶液中;②将氯化铝溶液分多次加入氢氧化钠溶液中,这两种操作结果正确的是( )
A. 现象相同,沉淀质量不同
B. 现象相同,沉淀质量也相同
C. 现象不同,沉淀质量相同
D. 现象不同,沉淀质量不同
难度: 困难查看答案及解析
-
检验某一溶液中是否含有氯离子,可选用的试剂是
A. 硝酸银溶液 B. 稀盐酸酸化的硝酸银溶液
C. 稀硝酸酸化的硝酸银溶液 D. 稀硫酸酸化的硝酸银溶液
难度: 中等查看答案及解析
-
某溶液中可能含有硫酸根离子、碳酸根离子等。为了检验其中是否含有硫酸根离子,除氯化钡溶液外,还需要的溶液是( )
A. 硫酸溶液 B. 盐酸溶液 C. 氢氧化钠溶液 D. 硝酸钠溶液
难度: 简单查看答案及解析
-
将10.6 g Na2CO3溶于水配制成1 000 mL溶液,从中取出20 mL,该溶液中Na+的物质的量浓度为( )
A. 0.1 mol•L﹣1 B. 0.2 mol•L﹣1
C. 0.05 mol•L﹣1 D. 0.025 mol•L﹣1
难度: 简单查看答案及解析
-
在水溶液中,下列电离方程式正确的是( )
A. Ca(OH)2===Ca2++2(OH-) B. FeCl3===Fe2++3Cl-
C. H2SO4===H++
D. Fe2(SO4)3===2Fe3++3
难度: 中等查看答案及解析
-
关于同温、同压下等体积的CO2和CO的叙述,其中正确的是( )
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
A. ①②③④ B. ②③④ C. 只有③④ D. 只有④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23 g Na与足量H2O反应完全后可生成NA个H2分子
B. 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4 L Cl2含NA个原子
D. 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
难度: 中等查看答案及解析
-
下列操作会使配制的氢氧化钠溶液的物质的量浓度偏高的是( )
A. 所用氢氧化钠已经潮解
B. 向容量瓶中加水,未到至刻度线
C. 没有洗涤烧杯及玻璃棒2~3次
D. 称量时,氢氧化钠固体和砝码放错托盘
难度: 中等查看答案及解析
-
电解质电离时一定相等的是( )
A. 阴离子与阳离子的总数 B. 阳离子和阴离子的质量
C. 正电荷总数和负电荷总数 D. 每个阳离子和阴离子所带电荷数
难度: 中等查看答案及解析
-
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol·L-1,c(Mg2+)=0.25mol·L-1,c(Cl-)=0.20mol·L-1,则c(SO42-)为
A.0.15mol·L-1 B.0.10mol·L-1 C.0.25mol·L-1 D.0.20mol·L-1
难度: 中等查看答案及解析
-
下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 稀硝酸与氢氧化钾溶液反应:H++OH﹣===H2O
B. 铝与稀盐酸反应:Al+2H+===Al3++H2↑
C. 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH﹣===Fe(OH)3↓+3Cl﹣
D. 足量二氧化碳与澄清石灰水反应:CO2+2OH﹣===
+H2O
难度: 中等查看答案及解析
-
大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是( )
A. ①③ B. ②③ C. ①④ D. ②④
难度: 中等查看答案及解析
-
下列各组气体在通常情况下既能用浓硫酸又能用碱石灰干燥的是( )
A. SO2、O2、N2 B. HCl、Cl2、CO2
C. CH4、H2、CO D. SO2、O2、Cl2
难度: 简单查看答案及解析
-
华裔科学家高锟因“在光学通信领域中光在光导纤维中传输”的研究方面所取得的开创性成就获得了诺贝尔物理学奖。光导纤维的主要成分是( )
A. Si B. SiO2 C. Na2SiO3 D. SiCl4
难度: 简单查看答案及解析
-
漂白粉在空气中放置易失效的主要原因是( )
A. Ca(ClO)2不稳定,易分解 B. Ca(ClO)2易吸收水分而潮解
C. Ca(ClO)2跟空气中的水和CO2反应 D. Ca(ClO)2跟空气中的CO2反应
难度: 中等查看答案及解析
-
Fe、Mg、Al分别跟稀盐酸充分反应得到相同质量的氢气,其原因是( )
①Fe、Mg、Al的物质的量相等,盐酸足量;
②Fe、Mg、Al的质量比是56∶24∶27,盐酸足量;
③Fe、Mg、Al的质量比是28∶12∶9,盐酸足量;
④Fe、Mg、Al均过量,所用盐酸的浓度和体积都相同。
A. ①② B. ①③ C. ②③ D. ③④
难度: 中等查看答案及解析
-
下列叙述中,不属于氮的固定的方法是( )
A. 根瘤菌把氮气变为硝酸盐 B. 氮气和氢气合成氨
C. 从液态空气中分离氮气 D. 氮气和氧气合成一氧化氮
难度: 简单查看答案及解析
-
已知2FeSO4
Fe2O3+SO2↑+SO3↑,把产生的气体通入BaCl2溶液中,则( )
A. 产生BaSO4和BaSO3两种沉淀
B. 产生BaSO4沉淀,SO2从溶液中逸出
C. 产生BaSO4沉淀,无SO2气体逸出
D. 产生的沉淀中含BaSO4,并有HCl气体逸出
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
难度: 简单查看答案及解析