-
下列热化学方程式书写正确的是
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H=+57.3 kJ/mol(中和热)
C. S(s)+O2(g) =SO2(g) △H=-296.8 kJ/mol(反应热)
D. 2NO2=O2+2NO △H=+116.2 kJ/mol(反应热)
难度: 简单查看答案及解析
-
只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是
A.K值不变,平衡可能移动
B.平衡向右移动时,K值不一定移动
C.K值有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍
难度: 中等查看答案及解析
-
下列有关能源与能量的说法正确的是 ( )
A. 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B. 蒸汽属于一次能源
C. 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D. 反应物和生成物的总能量决定反应是放热还是吸热
难度: 简单查看答案及解析
-
下列说法完全正确的是 ( )
A. 放热反应均是自发反应
B. ΔS 为正值的反应均是自发反应
C. 物质的量增加的反应,ΔS为正值
D. 如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 参加反应物质的性质是决定化学反应速率的主要因素
B. 化学反应速率只能加快不能减慢
C. 决定化学反应速率的主要因素是浓度
D. 增加反应物的用量一定能增大反应速率
难度: 中等查看答案及解析
-
某学生欲完成反应Cu+H2SO4===CuSO4+H2↑而设计了下列四个实验,你认为可行的是
A.
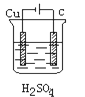 B.
B.  C.
C. 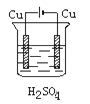 D.
D. 
难度: 中等查看答案及解析
-
等物质的量浓度和等体积的两份稀硫酸a和b中,分别加入过量的锌粉,并向a中加入少量硫酸铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是
A. 铝片与稀盐酸反应 B. 甲烷在氧气中燃烧
C. 灼热的炭与二氧化碳反应 D. Ba(OH)2·8H2O与NH4Cl反应
难度: 中等查看答案及解析
-
A、B、C、D四种金属,将AB用导线连接后,浸在稀硫酸中,在A上有氢气放出,而B溶解;当活泼金属浸在含有A和C两种金属离子可溶性盐溶液里时,在活泼金属上先析出C,把D放入B的硝酸盐溶液中,则D表面有B析出.这四种金属的活动性由强到弱的顺序是( )
A.A>B>C>D B.D>B>A>C C.D>C>B>A D.D>B>C>A
难度: 中等查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系式为( )
A. 4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 2υ(NH3)=3υ(H2O) D. 4υ(O2)=5υ(NO)
难度: 中等查看答案及解析
-
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
能使水的电离平衡右移,且水溶液显碱性的离子是( )
A. HSO3﹣ B. OH﹣
C. Al3+ D. HCO3﹣
难度: 中等查看答案及解析
-
下列各烧杯中均盛着海水,其中铁腐蚀最快的是( )
A.
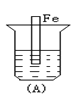 B.
B. 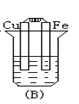 C.
C. 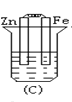 D.
D. 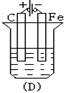
难度: 中等查看答案及解析
-
下列关于铜电极的叙述中不正确的是
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
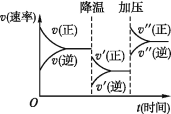
A. 正反应是吸热反应
B. 若A、B是气体,则D是液体或固体
C. 逆反应是放热反应
D. A、B、C、D均为气体
难度: 中等查看答案及解析
-
已知2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ/mol,CO(g)+1/2O2(g)=CO2(g)△H=﹣282.9kJ/mol,某H2和CO的混合气体完全燃烧时放出113.74kJ的热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为( )
A. 2:1 B. 1:2
C. 1:1 D. 2:3
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3 mol/L B. Y2为0.4 mol/L
C. X2为0.2 mol/L D. Z为0.4 mol/L
难度: 中等查看答案及解析
-
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
难度: 困难查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ⑤⑦⑧
难度: 简单查看答案及解析