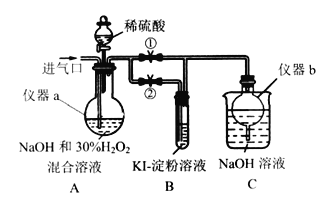
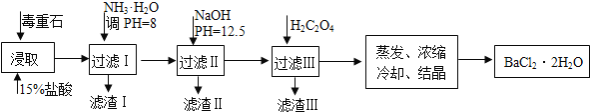
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式________________________________________;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)= 2CH3OCH3(g)的反应热为_______________________;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g)
CH3OCH3(g)+ 3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将_____________ (填“变大”、“变小”或“不变”)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式__________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置如图所示:
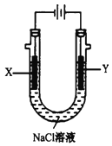
请写出电解过程中Y电极附近观察到的现象是_______________________;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH=_______________________(假设溶液的体积不变,气体全部从溶液中逸出)。
难度: 简单查看答案及解析
-
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________。
(3)NH3的沸点比PH3高,原因是___________;PO43-离子的立体构型为___________。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏加德罗常数的值为NA,则该晶体的密度为__________________g/cm3(只要求列算式,不必计算)。
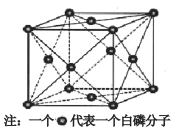
难度: 困难查看答案及解析
-
华法林(Warfarin)又名杀鼠灵,美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
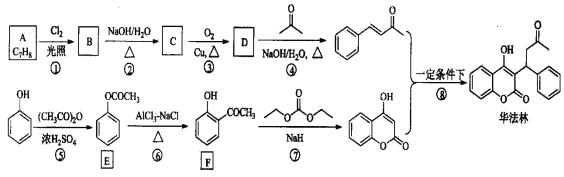
请回答下列问题:
(1)A的名称为_____________________,E中官能团名称为____________________。
(2)B的结构简式为___________________________。
(3)由C生成D的化学方程式为________________________________________。
(4)⑤的反应类型为____________,⑧的反应类型为_______________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。a.能与FeCl3溶液发生显色反应; b.能发生银镜反应;其中核磁共振氢谱为五组峰的结构简式为_____________。
难度: 中等查看答案及解析